Degviela, ko izmanto lielākajā daļā automašīnu, ir benzīns un etanols. Šo divu degvielu pilnīga sadedzināšana rada oglekļa dioksīdu (CO2. punkta g) apakšpunkts) un ūdeni (H2O). Diemžēl nepilnīga sadegšana un spirta un benzīna piemaisījumi var radīt vielas, kas ļoti piesārņo vidi. Benzīna gadījumā oglekļa monoksīds (COg)); ogļūdeņraži (savienojumi, kas sastāv no oglekļa un ūdeņraža), piemēram, etāns (C.2H6. g)); un slāpekļa oksīdi (NOx), galvenokārt slāpekļa monoksīds (NO) un slāpekļa dioksīds (NO2. punkta g) apakšpunkts).
Tādējādi, lai izvairītos no gaisa piesārņojuma palielināšanās, visām automašīnām ir nepieciešams sauktais aprīkojums katalītiskais neitralizators vai katalītiskais neitralizators, kas ir pretpiesārņojuma ierīce, kuras funkcija ir apstrādāt šīs iekšdedzes dzinēja izdalītās gāzes un pārveidot tās par mazāk kaitīgām gāzēm. Šajā nolūkā dažos rūpnieciskos procesos tiek izmantoti arī katalītiskie neitralizatori.
Minētās piesārņojošās gāzes atstāj motoru un nonāk katalizatorā, izejot caur sava veida "stropu", kuru šūnas parasti ir izgatavotas no keramikas vai metāla materiāla, kas pārklāts ar alumīnija oksīdu (alumīnija oksīdu - Al
2O3). Šī šūnveida forma ar maziem kanāliem ir svarīga, jo tā nodrošina lielu kontaktu virsmu gāzēm, liekot tām ātrāk reaģēt.Bet patiesais katalizators ir metāls, kas atrodas virs alumīnija oksīda. Parasti izmantotie metāli ir pallādijs, rodijs, platīns vai molibdēns. Jūs varat arī sajaukt šos metālus un izmantot sakausējumus. Piemēram, benzīna gadījumā parasti izmanto palādija un torija sakausējumu; etanola gadījumā izmanto citu palādija un molibdēna sakausējumu. Šie metāli veic neviendabīgu katalīzi ar piesārņojošām gāzēm.
neviendabīga katalīze tas ir reakcijas veids, kurā katalizators ar reaģentiem (šajā gadījumā piesārņojošajām gāzēm) veido daudzfāžu sistēmu. Tas notiek tāpēc, ka katalizators adsorbējas, tas ir, tas notur reaģentu molekulas uz savas virsmas, vājinot to saites un liekot reakcijai noritēt ātrāk.
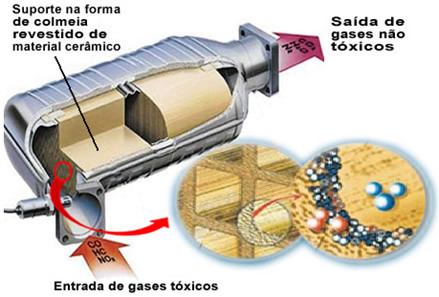
Rezultātā katalizējošie metāli pārveido tādus piesārņotājus kā CO un NOx netoksiskās gāzēs, piemēram, CO2, H2O, O2 un nē2. Skatiet dažas no šīm reakcijām zemāk un ņemiet vērā, ka caur tām notiek ogļūdeņražu oksidēšanās un CO (iegūts nepilnīgas sadedzināšanas rezultātā) un arī slāpekļa oksīdu reducēšana par slāpekļa gāzi (N2):
2 COg) + 2 NĒg) → 2 CO2. punkta g) apakšpunkts + 1 N2. punkta g) apakšpunkts
2 COg) + 1 O2. punkta g) apakšpunkts → 2 CO2. punkta g) apakšpunkts
2C2H6. g) + 7 O2. punkta g) apakšpunkts → 4 CO2. punkta g) apakšpunkts + 6 H2Ov)
2 NĒ2. punkta g) apakšpunkts +4 COg) → 1 N2. punkta g) apakšpunkts + 4 CO2. punkta g) apakšpunkts
2 NĒ2. punkta g) apakšpunkts → 1 N2. punkta g) apakšpunkts + 2 O2. punkta g) apakšpunkts
2 NĒg) → 1 N2. punkta g) apakšpunkts + 1 O2. punkta g) apakšpunkts
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm
