Starp atomu izpētes sarežģītībām nosaka atoma lielumu vai, vēl labāk, atomu stars. Šis periodiskais īpašums raksturo attālumu no kodola līdz tā elektronisko līmeņu visattālākajam elektronam. Lai to noteiktu, tiek veikts, piemēram, attāluma starp divu atomu kodoliem, kas veido vienkāršu vielu, vidējais aritmētiskais.
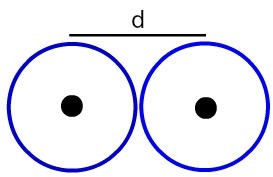
Attāluma attēlojums starp diviem atomu kodoliem
Noteiksim atoma rādiuss (RA) no attēlā redzamajiem atomiem. Lai to izdarītu, vienkārši sadaliet attālumu starp serdeņiem ar 2:
RA = d
2
O atomu staru izpēte ir svarīgs, jo tas veicina izpratni par dažiem fiziskiem notikumiem (blīvums, kodolsintēze, viršanas temperatūra un jonizācijas enerģija) un ķīmiskās vielas (ķīmiskās saites), kas rodas ar atomi.
Analizējot periodisko tabulu, mēs varam novērtēt, vai atoms ir lielāks vai mazāks attiecībā pret citu, un tādējādi noteikt, vai tam ir lielāka vai mazāka vieglums, ja viens vai vairāki elektroni tiek noņemti no orbitālēm. atomu rādiusa novērtēšana un noteikšana periodiskajā tabulā tiek veikts pēc diviem pamatkritērijiem:
a) Enerģijas līmeņu skaits (ģimenes vai grupas / vertikālās kolonnas)
Mēs zinām, ka atomiem var būt līdz septiņiem enerģijas līmeņiem (K, L, M, N, O, P, Q) un ka katram ķīmiskais elements atrodas grupās vai grupās (vertikālās kolonnas) un periodos (kolonnas horizontāli). Periodi norāda elementa atoma līmeņu skaitu, un ģimene norāda atoma enerģētiskāko apakšlīmeni. Grupā vai ģimenē ķīmiskie elementi atšķiras pēc enerģijas līmeņa daudzuma. Skatīt zemāk esošo tabulu:

Jo lielāks ir atoma enerģijas līmeņu skaits, jo lielāks ir tā atoma rādiuss. Analizējot iepriekšējo tabulu, var redzēt, ka francijam ir vislielākais atoms, jo tam ir septiņi līmeņi. Savukārt kālija atomam ir mazāks rādiuss, jo tam ir četri enerģijas līmeņi. Šis ir salīdzinošs attēlojums starp franka un kālija atomu:
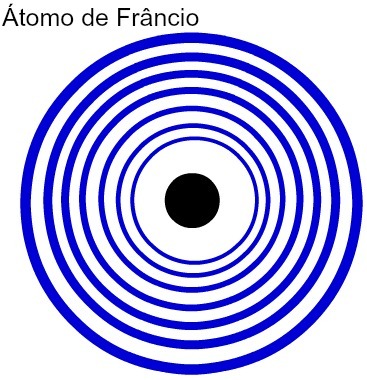
Francija atoma septiņu enerģijas līmeņu attēlojums

Kālija atoma četru enerģijas līmeņu attēlojums
Šī diagramma parāda, kā notiek atomu rādiusa pieaugums tajā pašā periodiskās tabulas ģimenē vai grupā (vertikālās kolonnas). Jo lielāks līmeņu skaits, jo lielāks rādiuss, tas ir, periodiskajā tabulā atomu rādiuss aug no augšas uz leju:
Attēls par to, kā atomu rādiuss palielinās periodisko tabulu saimē
b) Atomu skaitlis (Z vai protonu skaits) tajā pašā periodā (horizontālā kolonna)
Kad ķīmiskie elementi pieder vienam un tam pašam periodam, to atomiem ir vienāds enerģijas līmenis, bet protonu daudzums to kodolos ir atšķirīgs. Tālāk ir parādīta elementu secība, kas pieder periodiskās tabulas ceturtajam periodam:
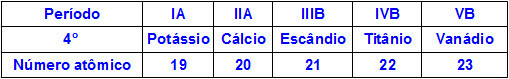
Visiem iepriekš tabulā attēloto elementu atomiem ir četri enerģijas līmeņi, taču katra no tiem kodolos ir atšķirīgs daudzums protonu. Kamēr protoni kodola iekšienē pievilcīgi iedarbojas uz elektroniem, kas atrodas enerģijas līmeņos, jo lielāks protonu daudzums kodolā, jo lielāka to piesaiste elektroniem. Rezultāts ir līmeņu tuvinājums kodolam, samazinot atoma lielumu.
↑Z = ↓ Atoma rādiuss
↓Z = ↑ Atomu rādiuss
Tādējādi mēs varam apgalvot, ka kālija elementa atoma rādiuss ir lielāks nekā vanādijam, jo ir mazāks protonu skaits.
Šī diagramma parāda, kā atoma rādiuss palielinās tajā pašā periodā (horizontālā līnija). Jo mazāks atomu skaitlis, jo lielāks rādiuss, tas ir, tabulas atomu rādiuss aug no labās uz kreiso
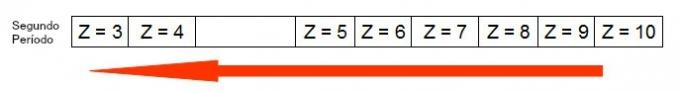
Attēls par to, kā atomu rādiuss palielinās periodiskās tabulas periodā
Autors: Diogo Lopes Dia

