jonizācija ir ķīmiskā parādība, kurā skābā viela (kuras vispārējā formula ir HX), izšķīdinot ūdenī, rada divus jonus: hidronija katjonu (H3O+ vai H+) un jebkuru anjonu (X-). Fenomens tiek attēlots no vienādojuma. Skaties:
HX + H2O → H3O+ + X-
Jonizācijas laikā tikai jonizējamie ūdeņraži no skābe tie tiek pārveidoti hidronija katjonos, faktors, kas atkarīgs arī no šīs skābes jonizācijas spējas, tas ir, no jonizācijas pakāpes (α). Tādējādi ne visi ūdeņradis veido hidroniju, ja vien skābes jonizācijas pakāpe nav vienāda ar 100%.
Tomēr, kad mēs esam izveidojot jonizācijas vienādojumu, mēs neņemam vērā skābes jonizācijas pakāpi, bet gan daudzumu jonizējamie ūdeņraži ka viņš pasniedz.
Parasti jonizējamo ūdeņradi mēs uzskatām par visu ūdeņradi, kas atrodas ūdeņražskābē. Okskābju gadījumā jonizējami ir tikai ūdeņraži, kas saistīti ar oglekļa atomiem, kā redzams zemāk parādītajā strukturālajā formulā:
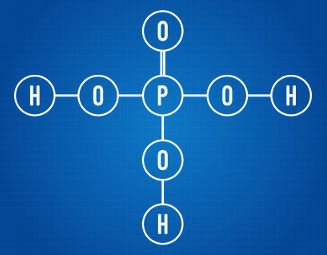
Fosforskābē ir trīs jonizējami ūdeņraži
Analizējot iepriekš minēto strukturālo formulu, mēs varam redzēt, ka attiecīgajā skābē ir trīs ūdeņraža atomi, kas saistīti ar skābekļa atomiem. Tādā veidā tam kopumā ir trīs jonizējami ūdeņraži.
Skatiet dažus montāžas piemērus dažu skābju jonizācijas vienādojuma:
1. piemērs: Bromūdeņražskābe (HBr)
HBr + H2O → H3O+ + Br-
Bromūdeņražskābe ir ūdeņražskābe, kuras sastāvā ir tikai viens ūdeņradis. Tā kā visu ūdeņradi ūdeņražā var jonizēt, tas, izšķīdinot ūdenī, veidojas tikai viens mols hidronija katjona tas ir bromīda anjons (Br-).
2. piemērs: Sērūdeņradis (H2S)
H2Y + 2 H2O → 2 H+ + S-2
Sērūdeņradis ir ūdeņražskābe, kuras sastāvā ir divi ūdeņraži. Tā kā visu ūdeņradi ūdeņražā var jonizēt, tas, izšķīdinot ūdenī, veidojas divi moli hidronija katjonu tas ir sulfīda anjons (S-2). Šim nolūkam mēs izmantojām divi moli ūdens.
3. piemērs: mangānskābe (H2MnO4)
H2MnO4 + 2 H2O → 2 H3O+ + MnO4-2
Mangānskābe ir skābes skābe, kuras sastāvā ir divi ūdeņraži. Tāpat kā skābes skābēs, jonizējams ir tikai ar skābekli saistīts ūdeņradis - mangānskābes gadījumā abi ūdeņraži ir -, tas izšķīdīs ūdenī, divi moli hidronija katjonu tas ir manganāta anjons (MnO4-2). Šim nolūkam mēs izmantojām divi moli ūdens.
4. piemērs: Fosforskābe (H3Putekļi3)
H3Putekļi3 + 2 H2O → 2 H3O+ + HPO3-2
Fosforskābe ir skābes skābe, kuras sastāvā ir trīs ūdeņraži. Tāpat kā skābes skābēs, jonizējams ir tikai ar skābekli saistīts ūdeņradis - fosforskābes gadījumā abi ūdeņraži ir -, tas izšķīst, izšķīdinot ūdenī, divi moli hidronija katjonu tas ir fosfīta anjons (HPO3-2). Šim nolūkam mēs izmantojām divi moli ūdens.
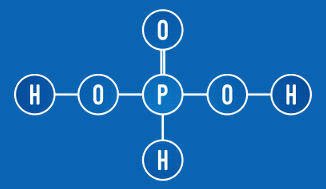
Fosforskābē ir divi jonizējami ūdeņraži (OH grupa)
5. piemērs: Borskābe (H3BO3)
H3BO3 + 3 H2O → 3 H+ + BO3-3
Borskābe ir skābes skābe, kuras sastāvā ir trīs ūdeņraži. Tāpat kā skābes skābēs, jonizējams ir tikai ar skābekli saistīts ūdeņradis - borskābes gadījumā trīs ūdeņraži ir -, tas izšķīst, izšķīdinot ūdenī, trīs moli hidronija katjonu tas ir borāta anjons (BO3-3). Šim nolūkam mēs izmantojām trīs moli ūdens.
6. piemērs: Pirofosforskābe (H4P2O7)
H4P2O7 + 4 H2O → 4 H3O+ + P2O7-4
Pirofosforskābe ir skābes skābe, kuras sastāvā ir četri ūdeņraži. Tāpat kā skābes skābēs, jonizējams ir tikai ar skābekli saistīts ūdeņradis - borskābes gadījumā četri ūdeņraži ir -, tas izšķīst, izšķīdinot ūdenī, četri moli hidronija katjonu tas ir anjonspirofosfāts (P.2O7-4). Šim nolūkam mēs izmantojām četri moli ūdens.
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/equacoes-ionizacao-dos-acidos.htm