Pētījums par a skābe ir ļoti svarīgi, lai noteiktu skābā šķīduma spēju vadīt elektrisko strāvu, jo tas attiecas uz jonu daudzumu, ko šī viela rada, nonākot saskarē ar ūdeni (jonizācija). Ja skābe ir pārāk stipra, tā rada pārāk daudz hidronija katjonu (H3O+) un daudzi anjoni (X-). Skatīt hidrobromskābes jonizācijas vienādojumu:
HBr + H2O → H3O+ + Br-
Jonizējot, skābes molekulā esošais ūdeņradis mijiedarbojas ar ūdens molekulu un veido hidroniju. Bet, lai šis notikums notiktu, ūdeņraža atomam obligāti jābūt jonizējamam. Jonizējamais ūdeņradis ir tāds, kas spēj veidot hidronija katjonu.. Lai uzzinātu, vai ūdeņradis ir jonizējams, mēs ņemam vērā skābes klasifikāciju kā ūdeņražskābi (tās sastāvā nav skābekļa) vai oksidskābi (sastāvā ir skābeklis).
a) Hidracīdi
Viss ūdeņradis ūdeņražskābē tiek uzskatīts par jonizējamu.
Piemēri:
- HCl: jonizējams ūdeņradis, tādējādi iegūstot hidroniju;
- H2S: divi jonizējami ūdeņraži, pēc tam iegūst divus hidronus
b) Okskābe
Okskābē tikai ūdeņradis, kas molekulā ir saistīts ar skābekļa atomu, tiek uzskatīts par jonizējamu.
Šim nolūkam ir jāveido tā strukturālā formula. Skatiet dažus piemērus:H3Putekļi4 (fosforskābe)
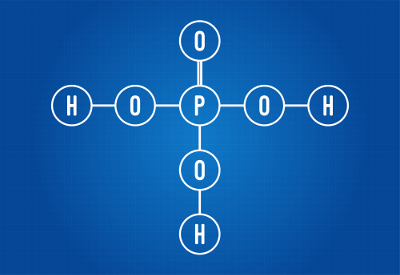
Fosforskābes strukturālā formula
Mēs varam redzēt, ka fosforskābes struktūrā ir trīs ūdeņraži, kas saistīti ar skābekli, tātad ir trīs jonizējami ūdeņraži. Jonizācijas vienādojums būs:
H3Putekļi4 + 3 H2O → 3H3O+ + PO4-3
H2TIKAI4 (sērskābe)
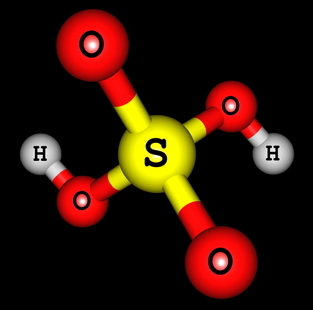
Sērskābes strukturālā formula
Mēs varam redzēt, ka sērskābes struktūrā ir divi ūdeņraži, kas saistīti ar skābekli, tātad ir divi jonizējamie ūdeņraži. Jonizācijas vienādojums būs:
H2TIKAI4 + 2 H2O → 2 H3O+ + OS4-2
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/hidrogenios-ionizaveis.htm
