Ja būtu iespējams ļoti skaidri vizualizēt metāla struktūru, mēs to redzētu kā attēlā iepriekš. Metālu atomu struktūra ir kristāliska, kas sastāv no metāla katjoniem, kurus ieskauj elektroni.
Metālos esošos kristāliskos režģus var attēlot šādi: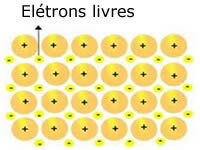
Metāliskā nātrija (Na) attēlojums
Metālu kristāliskos režģus veido fiksētu katjonu grupa.
Katru Na + katjonu ieskauj elektroni, bet tie ir delokalizēti, tas ir, tos nepiesaista neviens kodols.
Tā kā starp negatīvajiem lādiņiem (elektronu) un pozitīvo kodolu (katjonu) nav pievilcības, brīvie elektroni galu galā aizņem visu metāla kristālisko režģi. Brīvība, kas jāpārvieto elektroniem, liek viņiem veidot elektronisku mākoni.
Metālu spēja vadīt elektrību ir izskaidrojama ar šī mākoņa klātbūtni. Elektriskā strāva rodas brīvo elektronu saskarē ar citiem metāliem.
Jebkura atoma sastāvā, ieskaitot tādus metālus kā nātrijs (Na), zelts Au, varš (Cu), ir valences slānis. Elektroni brīvi pārvietojas pa šo slāni, saglabājot katjonu elektromagnētisko pievilcību. Šī strukturālā īpašība ļauj veidot metāla molekulas un līdz ar to arī pašus metālus.
Autore Líria Alves
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm

