Gatavojot ēdienu savās mājās, mēs izmantojam vārīšanas gāzes sadedzināšanu. Viena no lietām, ko mēs varam redzēt liesmā, kas rodas no šīs gāzes sadegšanas, ir tā, ka tās krāsa parasti ir ļoti gaiši zila. Tomēr lielākajā daļā sadegšanas reakciju, piemēram, sveces dedzināšana, liesma ir dzeltena.

Tad rodas jautājums:
"Ja katrs ugunsgrēks ir sadegšanas reakcijas rezultāts, kāpēc dažām liesmām ir dažādas krāsas?"
Lai saprastu, kā tas notiek, mums jāsaprot, kas ir degšanas reakcija un kādas vielas ir katrā no minētajām reakcijām.
Sadegšanas reakcija notiek, kad degviela (oksidējams materiāls) tiek patērēts oksidētāja (gāzveida materiāls, kas satur skābekli), lai radītu siltuma enerģiju (siltumu).
Vēl viens svarīgs punkts, kas mums jāzina par sadegšanas reakcijām, ir tas, ka tās var notikt a pilnīgs vai nepilnīgs. Ja degvielas patēriņam ir pietiekami daudz skābekļa, reakcija būs pilnīga un radīs oglekļa dioksīdu (CO2) un ūdeni (H2O). Pretējā gadījumā degšana būs daļēja, nepilnīga, radot oglekļa monoksīdu (CO) un ūdeni; vai ogleklis (C) un ūdens.
Abos gadījumos mēs analizējam, ka oksidētājs ir skābeklis, kas atrodas gaisā. Tomēr degvielas ir atšķirīgas. Vārāmā gāze faktiski ir sašķidrināta naftas gāze (LPG), kas ir ogļūdeņražu (alkānu) maisījums, galvenā degviela ir butāns (C4H10). Tādējādi vārīšanas gāzi veido alkāna molekulas, kurām ir tikai trīs vai četri oglekļa atomi, tāpēc tā sadegšanai pilnībā nepieciešams maz skābekļa. Šo reakciju var izteikt šādi:
1C4H10. g) + 13/2 O2. punkta g) apakšpunkts → 4 CO2. punkta g) apakšpunkts + 5 stundas2Og), ∆H <0
Sveces gadījumā parafīns ir reakcijas degviela, un to veido alkānu maisījums ar oglekļa atomiem, svārstās no 20 līdz 36. Tādējādi lai šī reakcija notiktu pilnībā, nepieciešams daudz vairāk skābekļa. Skatiet piemēru:
1C24H50 (s) + 70/2 O2. punkta g) apakšpunkts → 25 CO2. punkta g) apakšpunkts + 25 H2Og), ∆H <0
Gaisā nav pietiekami daudz skābekļa, lai veiktu šo pilnīgo sadedzināšanu, tāpēc tas notiek nepilnīgi, kā parādīts zemāk:
1C24H50 (s) +49/2 O2. punkta g) apakšpunkts → 24 COg) + 25 H2Og), ∆H <0
1C24H50 (s) +25/2 O2. punkta g) apakšpunkts → 24Cs) + 25 H2Og), ∆H <0
Nepilnīgas reakcijas rada mazāk enerģijas nekā pilnīga sadegšana. Tas izskaidro atšķirību starp liesmu krāsām, jo nepilnīgai sadegšanai raksturīgajai dzeltenajai liesmai ir mazāka enerģija. Zilā liesma ir raksturīga pilnīgai sadedzināšanai, ar lielāku enerģiju.
Tas izskaidro arī kvēpu veidošanos ar sveces liesmu (attēlā zemāk), kas ir ogleklis, ko uzskata par nepilnīgas sadegšanas produktu.
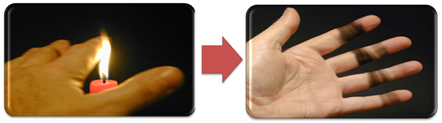
Bet kāpēc Bunsen deglī ir iespējams iegūt dzeltenas un zilas liesmas, ja degviela nemainās?
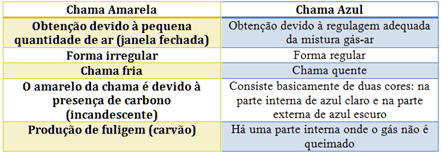
Bunsen degļa gadījumā to panāk, regulējot gāzes un gaisa ieplūdi. Ja logs ir aizvērts, izraisot nelielu gaisa daudzumu, iegūtā liesma būs dzeltena, jo tai būs maz skābekļa, lai veiktu pilnīgu sadedzināšanu. Ja gāzes un gaisa maisījuma regulējums ir pietiekams, mēs iegūstam zilu liesmu.
Katra raksturlielumus skatiet zemāk esošajā tabulā:
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm

