Uz Periodiskās tabulas ģimenes ir tabulas vertikālās secības un apkopo ķīmiskie elementi ar līdzīgām ķīmiskajām īpašībām. Šādas līdzības ir saistītas ar vienādu valences elektronu daudzumu elementiem, kas sagrupēti vienā ģimenē. Ģimenes izmitina reprezentatīvos elementus 1. un 2. grupā no 13 līdz 18 un pārejas elementus no 1. līdz 12. grupām.
Izlasi arī:Transurāniskie elementi — cilvēka radītie ķīmiskie elementi, kas nāk pēc urāna periodiskajā tabulā
Šī raksta tēmas
- 1. Periodiskās tabulas saimju kopsavilkums
- 2 - Periodiskās tabulas ģimeņu organizēšana
-
3. Periodiskās tabulas ģimeņu nomenklatūra
- → Periodiskās tabulas reprezentatīvie elementi
- → Periodiskās tabulas pārejas elementi
- 4. Periodiskās tabulas saimes ķīmiskie elementi
-
5. Periodiskās tabulas saimes galvenās īpašības
- → 1. grupa vai sārmu metālu saime
- → 2. grupa vai sārmzemju metālu saime
- → 3. līdz 12. grupa vai pārejas metālu saime
- → 13. grupa jeb boru ģimene
- → 14. grupa jeb oglekļa saime
- → 15. grupa jeb slāpekļa saime
- → 16. grupa jeb skābekļa ģimene (halkogēni)
- → 17. grupa vai halogēnu grupa
- → 18. grupa jeb cēlgāzes saime
-
6 - Periodiskā tabula un elektroniskā izplatīšana
- → Reprezentatīvo elementu elektroniskā izplatīšana
- → Pārejas elementu elektroniskā sadale
- 7 - Atrisināti vingrinājumi par periodiskās tabulas ģimenēm
Periodiskās tabulas ģimeņu kopsavilkums
Ģimenes atbilst vertikālajām līnijām Periodiskā tabula.
Periodiskajā tabulā ģimenes, kas pazīstamas arī kā grupas, ir numurētas no 1 līdz 18.
Ķīmiskajiem elementiem vienā saimē ir līdzīgas ķīmiskās īpašības.
Elementu kopas pazīstamība ir izskaidrojama ar vienādu valences elektronu skaitu.
Reprezentatīvie elementi ir sadalīti grupās 1, 2, 13, 14, 15, 16, 17 un 18. Katrai no šīm ģimenēm ir noteikti vārdi.
Pārejas elementi veido vienu ģimeni, kas ir sadalīta grupās 3, 4, 5, 6, 7, 8, 9, 10, 11 un 12.
Nepārtrauciet tagad... Pēc publicitātes ir vēl kas ;)
Periodiskās tabulas ģimeņu organizācija
Ģimenes periodiskajā tabulā ir tabulas vertikālās secības, tas ir, kolonnas. Zināmas arī kā grupas, periodiskās tabulas ģimenes ir numurēti no 1 līdz 18, no kreisās puses uz labo.
Ķīmiskie elementi, kas aizņem vienu kolonnu, tiek uzskatīti par vienā saimē., to ķīmisko īpašību līdzības dēļ, kas ir saistīts ar to, ka tiem ir vienāds skaits elektroni plkst valences apvalks. Piemēram, visiem 18. saimes ķīmiskajiem elementiem valences apvalkā (pilnajā apvalkā) ir astoņi elektroni, un tie reti piedalās ķīmiskās saites.
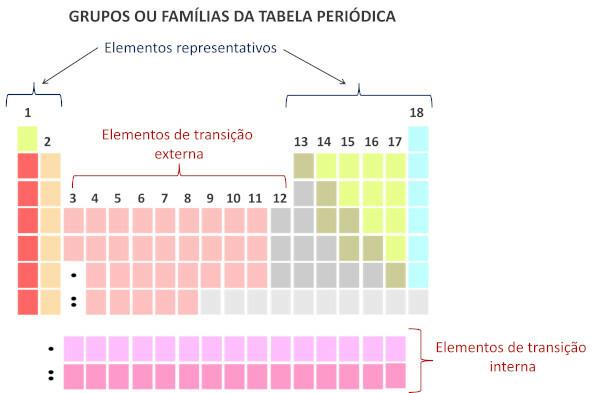
Saskaņā ar mūsdienu sistēmu Starptautiskā tīrās un lietišķās ķīmijas savienība (Iupac), katra grupa vai ģimene tiek identificēta ar skaitli no 1 līdz 18, sākot no kreisās uz labo pusi periodiskajā tabulā.
Ir svarīgi uzsvērt, ka vecā IUPAC sistēma pieņēma burtciparu sistēmu ar burtiem A un B, lai attiecīgi apzīmētu reprezentatīvos un pārejas elementus. Pašlaik šāda veida nomenklatūra vairs netiek izmantota.
Periodisko tabulu ģimeņu nomenklatūra
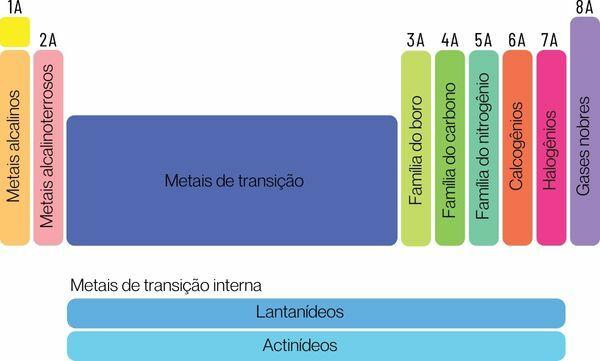
Ķīmiskos elementus var iedalīt divās lielās saimēs: reprezentatīvie elementi un pārejas elementi.
→ Periodiskās tabulas reprezentatīvie elementi
Reprezentatīvie elementi ir sadalīti grupās 1, 2, 13, 14, 15, 16, 17 un 18. Katrai no šīm grupām ir noteikts nosaukums, ar kuru to var arī atpazīt. Skaties:
1. grupa: ģimene metāli sārmains.
2. grupa: ģimene sārmzemju metāli.
13. grupa: bora vai zemes metālu saime.
14. grupa: oglekļa ģimene.
15. grupa: Slāpeklis vai Pnicogens ģimene.
16. grupa: skābekļa vai halkogēna ģimene.
17. grupa: ģimene halogēni.
18. grupa: ģimene cēlgāzes.
→ Periodiskās tabulas pārejas elementi
Tu pārejas elementiveido vienu ģimeni, kas sadalīta grupās 3, 4, 5, 6, 7, 8, 9, 10, 11 un 12. Lantanīda un aktinīdu sērijas arī ir daļa no pārejas elementiem.
Pārejas elementi visi ir metāliski un tiem ir līdzīgas ķīmiskās īpašības, pat ja valences apvalkā ir dažādi elektroni, un tāpēc tie veidotu vienu un lielu pārejas metālu saimi.
Ķīmiskie elementi no periodiskās tabulas ģimenēm
Katra ģimene vai grupa sastāv no ķīmisko elementu kopuma. Skatiet ķīmisko elementu aprakstu, kas veido katru saimi:
1. grupa:litijs, nātrijs, kālijs, rubīdijs, cēzijs, francijs.
2. grupa:berilija, magnijs, kalcijs, stroncijs, bārijs, radio.
3. grupa:skandijs, itrijs, lantanīda sērija un aktinīdu sērija.
4. grupa: titāns, cirkonija oksīdsO, hafnijs Tas ir rutherfordijs.
5. grupa:vanādijs, niobijs, tantals Tas ir dubnium.
6. grupa:hroms, molibdēns, volframs Tas ir Seaborgium.
7. grupa:mangāns, tehnēcijs, rēnijs Tas ir bohrio.
8. grupa: dzelzs, rutēnijs, osmijs Tas ir hassijs.
9. grupa:kobalts, rodijs, irīdijs un meitnērijs.
10. grupa:niķelis, palādijs, platīns un darmstadtio.
11. grupa: varš, Sudrabs, zelts un rentgens.
12. grupa:cinks, kadmijs, Merkurs un Koperniks.
13. grupa: bors, alumīnija, gallijs, indijs un tallijs.
14. grupa: ogleklis, silīcijs, germānija, skārda, svins un flerovijs.
15. grupa:slāpeklis, fosfors, arsēns, antimons Tas ir bismuts.
16. grupa:skābeklis, sērs, selēns, telūrs, polonijs un hevermorijs.
17. grupa: fluors, hlors, broms, jods un astatīns.
18. grupa:hēlijs, neona, argons, kriptons, ksenons Tas ir radons.
Svarīgs: ķīmiskais elements ūdeņradis ir īpašs gadījums, jo, neskatoties uz to, ka tas atrodas blakus 1. grupai, tas neietilpst sārmu metālu saimē, jo tam nav līdzīgu ķīmisko īpašību.
Uzziniet vairāk: Kādi ir radioaktīvie elementi periodiskajā tabulā?
Periodiskās tabulas ģimeņu galvenie raksturlielumi
Tie ir metāliski cieti, spīdīgi un gludi.
Viņiem ir augsta siltumvadītspēja un augsta Elektriskā vadītspēja.
ir temperatūras salīdzinoši zema kušanas pakāpe.
Viņi ļoti reaģē ar ūdens.
Tendence veidot monovalentus katjonus (lādiņš +1).
Tās ir metāliskas cietas vielas, spīdīgas un cietākas salīdzinājumā ar sārmu metāliem.
Tie viegli oksidējas.
Viņiem ir augsta siltumvadītspēja un augsta elektrovadītspēja.
Viņiem ir nedaudz augstāka kušanas temperatūra salīdzinājumā ar sārmu metāliem.
Tie reaģē ar ūdeni.
Tendence veidot divvērtīgus katjonus (lādiņš +2).
Tās ir lielākā ģimene periodiskajā tabulā.
Cietas, spīdīgas metāliskas cietvielas.
Viņiem ir augsta siltumvadītspēja un augsta elektrovadītspēja.
Blīvs.
Augsta kušanas temperatūra.
var parādīties atšķirīgi oksidācijas stāvokļi.
→ 13. grupa jeb boru ģimene
Tiem ir starpposma īpašības starp metālu īpašībām un nevis metāli.
Apkārtējās vides apstākļos tie ir cieti.
Tendence veidot trīsvērtīgus katjonus (lādiņš +3).
→ 14. grupa jeb oglekļa saime
Tiem ir starpposma īpašības starp metālu un nemetālu īpašībām.
Apkārtējās vides apstākļos tie ir cieti.
Tendence veidot četras saites.
Apkārtējās vides apstākļos tie ir cieti.
Ogleklis un silīcijs var veidot ķēdes saites.
→ 15. grupa jeb slāpekļa saime
Tiem ir starpposma īpašības starp metālu un nemetālu īpašībām.
Cietas vielas apkārtējās vides apstākļos, izņemot slāpekli, kas ir gāze.
Slāpeklis un fosfors ir būtiski dzīvajos organismos.
Arsēns ir ļoti toksisks.
→ 16. grupa jeb skābekļa ģimene (halkogēni)
Tiem ir dažādas īpašības, mainoties no nemetāla elementiem uz metālisku elementu, ejot pa ģimeni.
Cietas vielas apkārtējās vides apstākļos, izņemot skābekli, kas ir gāze.
Tendence veidot divvērtīgus anjonus (lādiņš -2).
→ 17. grupa vai halogēnu grupa
Tie ir nemetāli.
Diezgan reaģējošs.
Slikti siltuma un elektrības vadītāji.
Apkārtējās vides apstākļos fluors un hlors pastāv kā gāzes, broms ir šķidrs un jods ir ciets.
Tendence veidot monovalentus anjonus (lādiņš -1).
→ 18. grupa jeb cēlgāzes saime
Tie ir nemetāli.
Ļoti maz reaģējošas, tāpēc tās var saukt par inertām gāzēm.
Tie pastāv gāzu veidā.
Viņiem nav tendence veidoties joni.
Periodiskā tabula un elektroniskā izplatīšana
Ķīmiskajiem elementiem, kas pieder vienai ģimenei vai grupai, ir līdzīgas ķīmiskās īpašības, jo tiem ir vienāds elektronu skaits valences apvalkā.
Elektronu skaits valences apvalkā ir būtisks, jo tas nosaka katjonu veidošanās tendenci vai anjoni, veidojamās ķīmiskās saites veids, ķīmiskajās reakcijās iesaistītā enerģija, cita starpā īpašības. Lai atrastu valences elektronu skaitu, ir nepieciešams zināt atomskaitlis no elementa un izpildiet savu elektroniskā izplatīšana.
→ Reprezentatīvo elementu elektroniskā izplatīšana
Reprezentatīvie elementi tiem ir enerģētiskākie elektroni apakšlīmeņos s Tas ir P elektroniskā slāņa (n). Nākamajā tabulā ir apkopotas elektroniskās konfigurācijas, kas saistītas ar katru reprezentatīvo elementu saimi. termiņš n svārstās no 1 līdz 7 un atspoguļo valences elektronu aizņemto enerģijas līmeni, kas ir līdzvērtīgs periodiskās tabulas periodam (horizontālajai līnijai), kurā elements atrodas.
Reprezentatīvo elementu elektroniskā izplatīšana | ||
ģimene vai grupa |
Elektroniskā izplatīšana |
Piemērs |
1 |
mums1 |
Li (Z=3): 1 s2 2s1 |
2 |
mums2 |
Be (Z=4): 1 s2 2s2 |
13 |
mums2 np1 |
B (Z=5): 1 s2 2s22p1 |
14 |
mums2 np2 |
C (Z=6): 1 s2 2s22p2 |
15 |
mums2 np3 |
N (Z=7): 1 s2 2s22p3 |
16 |
mums2 np4 |
O (Z=8): 1 s2 2s22p4 |
17 |
mums2 np5 |
F (Z=9): 1 s2 2s22p5 |
18 |
mums2 np6 |
Ne (Z=10): 1 s2 2s22p6 |
→ Pārejas elementu elektroniskā sadale
Pārejas elementi ir sadalīti starp 3. un 12. grupu un ir apakšlīmeņi d Tas ir f ko aizņem valences elektroni:
Ārējie pārejas elementi: uzturēt valences elektronus apakšlīmenī d, saglabājot elektronu konfigurāciju vienādu ar mums2 (n-1)d(no 1 līdz 8). Piemēram, elements niķelis (Z = 28) pieder grupai 10, un tā konfigurācija ir 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Iekšējie pārejas elementi: tie ir daļa no 3. grupas, bet ir “iekšējie” periodiskajai tabulai, kas ir paplašināta zem tās, 6. (lantanīdi) un 7. (aktinīdi) periodā. Šiem elementiem ir valences elektroni, kas aizņem apakšapvalku f un vispārējā elektroniskā konfigurācija mums2 (n-2)f(no 1 līdz 13). Piemēram, elements lantāns (Z = 57) ir pirmais elements lantanīdu sērijā, un tā elektronu konfigurācija ir 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
Zināt arī:Kāda ir periodiskās tabulas izcelsme?
Atrisināja uzdevumus par periodiskās tabulas ģimenēm
jautājums 1
(UFC — pielāgots) Attiecībā uz mūsdienu periodisko elementu klasifikāciju atzīmējiet patieso apgalvojumu:
A) Periodiskajā tabulā ģimenes vai grupas atbilst horizontālām līnijām.
B) Ģimenes elementiem ir ļoti dažādas ķīmiskās īpašības.
C) Ģimenē elementiem parasti ir vienāds elektronu skaits pēdējā apvalkā.
D) Laika posmā elementiem ir līdzīgas ķīmiskās īpašības.
E) Reprezentatīvie elementi ir sadalīti grupās no 3 līdz 12.
Izšķirtspēja:
Alternatīva C
Vienums A ir nepareizs: saimes vai grupas ir periodiskās tabulas kolonnas (vertikālās līnijas).
Vienums B un D nav pareizi: saimē elementiem ir līdzīgas ķīmiskās īpašības. Periodos elementiem ir viens un tas pats elektronu apvalks, ko aizņem valences elektroni.
C punkts ir pareizi: saimē elementiem ir vienāds elektronu skaits pēdējā apvalkā.
Elements E nav pareizs: reprezentatīvie elementi ir grupas 1, 2, 13, 14, 15, 16, 17 un 18. Pārejas elementi ir sadalīti grupās no 3 līdz 12.
2. jautājums
(EAM) Elementu A, B un C valences apvalkos ir šādas elektronu konfigurācijas:
A: 3s1
B: 4s2 4p4
C: 3s2
Pamatojoties uz šo informāciju, atlasiet pareizo opciju.
A) Elements A ir sārmu metāls.
B) Elements B ir halogēns.
C) Elements C ir halkogēns.
D) Elementi A un B pieder periodiskās tabulas trešajam periodam.
E) Trīs elementi pieder vienai periodiskās tabulas grupai.
Izšķirtspēja:
Alternatīva A
Punkts A pareizs: elementam A ir elektroniskais sadalījums, kas satur tikai vienu valences elektronu, tāpēc tas ietilpst periodiskās tabulas 1. grupā.
Nepareizs vienums B: elementam B ir 4s elektronu konfigurācija2 4p4, norādot, ka pēdējā apvalkā ir 6 elektroni un šis elements pieder 16. grupai (halkogēni).
Nepareizs C vienums: elementam C ir elektroniska konfigurācija ar 2 elektroniem pēdējā apvalkā, tātad tabulā tas ir 2. grupas elements.
Nepareizs vienums D: elements A pieder trešajam periodam (n = 3), bet elements B pieder ceturtajam periodam (n = 4).
Nepareizs vienums E: trim elementiem pēdējā apvalkā ir atšķirīgs elektronu daudzums, tāpēc tie nevar būt vienas saimes daļa.
Ana Luiza Lorenzen Lima
Ķīmijas skolotājs
Noklikšķiniet šeit, uzziniet, kas ir valences slānis, un uzziniet, kā to var identificēt.
Izprotiet, kā tiek veikta elektroniskā izplatīšana, un apskatiet piemērus.
Uzziniet par iekšējo pārejas elementu (aktinīdu un lantanīdu) īpatnībām, kas aizņem periodiskās tabulas 3. grupas sesto un septīto periodu.
Zināt esošos ķīmiskos elementus, izprotot, kas tie ir un kā tos attēlot.
Cēlgāzes ir vienīgie elementi, kas dabā atrodami izolētā veidā. Uzziniet vairāk par tiem šajā rakstā!
Uzziniet par halogēniem, to īpašībām, īpašībām un galvenajiem lietojumiem ikdienas dzīvē.
Uzziniet vairāk par sārmzemju metāliem, zinot to īpašības, īpašības un pielietojumu.
Izprotiet, kas ir atomskaitlis, un uzziniet, kādas ir atoma īpašības, kuras var noteikt pēc tā.
Pārbaudiet šeit, kas ir periodiskā tabula, un skatiet interaktīvu modeli, lai uzzinātu visus ķīmiskos elementus, kas to veido.

