O Šrēdingera atomu modelis ir izplatīta forma, ko izmanto, lai apzīmētu atoma apraksts atrisinot Šrēdingera vienādojumu, ko 1927. gadā ierosināja austriešu fiziķis Ervīns Šrēdingers. Vienādojums ir izveidots, pamatojoties uz svarīgiem novērojumiem, kas iegūti kvantu mehānikā, sniedzot stabilu pamatojumu atoma un elektrona enerģijai.
Šrēdingera iecerētais atoms ir balstīts uz viļņu-daļiņu dualitāti, uz nenoteiktības principu, starp citiem jēdzieniem, kas radās 20. gadsimta sākumā. Tas deva lielu progresu matērijas izpratnē, jo tas pavēra ceļu stabilākai izpratnei par polielektroniskajiem atomiem, kas nav iespējams ar Bora ierosināto atomu modeli.
Lasi arī: Atomu modeļi - modeļi, kas piedāvāti, lai izskaidrotu atoma struktūru
Kopsavilkums par Šrēdingera atomu modeli
Šrēdingera atomu modelis patiesībā ir atoma un elektronu apraksts, izmantojot Šrēdingera vienādojumu.
Šrēdingera vienādojums tika izstrādāts, veicot svarīgus pētījumus kvantu mehānikas jomā.
Viļņu-daļiņu dualitāte, nenoteiktības princips, citu teoriju starpā, bija būtiski svarīgi Šrēdingera vienādojuma izveidošanai.
Atrisinot Šrēdingera vienādojumu, ir iespējams aprakstīt gan atoma, gan elektrona enerģiju.
Pamatojoties uz Šrēdingera vienādojuma interpretāciju, var redzēt, ka elektroniem nav noteikta orbīta ap atomu, bet drīzāk eksistences varbūtības reģions apkārt no viņa.
Šrēdingera pētījumi paplašina izpratne par Bora ierosināto atomu, jo tie ļauj izprast polielektronisko atomu uzvedību.
Kāds ir Šrēdingera atomu modelis?
Šrēdingera atomu modelis ir parasts nosaukums uz kvantu mehāniku balstīta atoma modeļa apraksts. Šī modeļa galvenā īpašība ir elektronu pieņemtā viļņu-daļiņu dualitātes matemātiskā interpretācija. konkrēti, precīzi noteiktas elektrona trajektorijas aizstāšana ar elektrona pastāvēšanas varbūtību ap kodols.
Šāda interpretācija aizsākās ar austriešu zinātnieka Ervīna Šrēdingera darbu 1927. gadā pēc nozīmīgiem sasniegumiem. lai izprastu vielu kvantu mehānikas jomā, piemēram, fotoelektrisko efektu, nenoteiktības principu un dualitāti viļņu daļiņa.
Izpratne par Šrēdingera atomu modeli nav triviāla, jo tai tuvojas progresīvākos ķīmijas studiju līmeņos.
Eksperimentālais pamats Šrēdingera atomu modelim
Pirms Ervina Šrēdingera studijām bija nozīmīgi sasniegumi matērijas izpratne 20. gadsimta sākumā. Šādi eksperimenti aizsāka teorētisko zināšanu jomu, kas pazīstama kā kvantu mehānika, kas sniedz interpretācijas par daļiņu uzvedību tuvu vai zem atomu skalas. Šajā īpašajā Visumā klasiskās fizikas likumi, kas pazīstami arī kā Ņūtona fizika, bieži vien nav piemērojami vai nav pietiekami, lai izskaidrotu noteiktu uzvedību.
Lai iegūtu priekšstatu, mēs varam teikt, ka kvantu mehānika sākas ar tēmu, kas pazīstama kā ultravioletā katastrofa. Saskaņā ar klasisko fiziku melns ķermenis (karsts objekts), kura temperatūra atšķiras no nulles, papildus gamma starojumam un rentgena stariem izstaro intensīvu ultravioleto starojumu.
Tas nozīmē, ka mēs, cilvēki, ar mūsu temperatūru 36-37 °C, tumsā spīdētu (kvēlspuldžu sekas). Lieki piebilst, ka tās ir pilnīgas muļķības, jo, ja tā būtu, tumsas nebūtu.
Šajā kontekstā, 1900. gadā Makss Planks izveidoja koncepciju par cik daudz, tulkots kā “enerģijas paketes”, lai izskaidrotu enerģijas apmaiņu starp vielu un starojumu. Pēc viņa interpretācijas, ķermenim zemā temperatūrā (kā mums) nav pietiekami daudz enerģijas, lai izstarotu augstfrekvences ultravioleto starojumu.
Tādējādi ķermenis var izstarot augstfrekvences ultravioleto starojumu tikai tad, kad tas iegūst minimāli nepieciešamo enerģiju. Šajā stāvoklī enerģijas apmaiņa starp vielu un apkārtni notiek caur starojuma enerģijas paketēm.
Enerģijas paketes arī rada atšķirību salīdzinājumā ar klasisko fiziku. Runājot par enerģijas paketēm, tas attiecas uz enerģiju, kas tiek kvantificēta, tas ir, tas ir specifisks, ir ierobežojumu uzlikšana. Ņūtona fizikā enerģijas daudzumam, kas tiek apmainīts starp diviem objektiem, nav ierobežojumu.
Fotoelektrisks efekts
Lai Planka ierosinātās teorijas būtu stabilākas, bija vajadzīgi vairāk pierādījumu. Šajā kontekstā parādījās fotoelektriskais efekts., kas nodarbojas ar elektronu izmešanu no metāla, ultravioletā starojuma dēļ uz tā virsmas.
Saskaņā ar šīs teorijas novērojumiem neviens elektrons netiek izmests, kamēr starojums nesasniedz noteiktas vērtības frekvenci, kas raksturīga katram metālam. Kad šī frekvence ir sasniegta, elektroni tiek nekavējoties izmesti, un jo intensīvāka ir krītošā starojuma frekvence, jo ātrāks būs izmestais elektrons.
A skaidrojumu fotoelektriskajam efektam sniedza Alberts Einšteins. Pēc Einšteina domām, elektromagnētiskais starojums (piemēram, gaisma ir elektromagnētiskais starojums), ko izmanto elektronu izmešanai, sastāvēja no daļiņas, kas pazīstamas kā fotoni, un turklāt katru fotonu var interpretēt kā enerģijas paketi. Pamatojoties uz Planka pētījumiem, varēja secināt, ka ultravioletā starojuma fotoni ir enerģiskāki nekā redzamās gaismas fotoni.

Saduroties ar metāla virsmu, fotoni (elektromagnētiskā starojuma sastāvdaļas) apmainās ar enerģiju ar tur esošajiem elektroniem. Ja enerģija, ko absorbē elektrons no sadursmes ar fotoniem, ir pietiekami liela, tad tas tiks izmests. Lai uzzinātu vairāk par fotoelektrisko efektu, noklikšķiniet uz šeit.
viļņu-daļiņu dualitāte
Fotoelektriskais efekts radīja spēcīgu pamatu tam, ka elektromagnētiskais starojums sastāv no daļiņām (fotoniem). Tomēr daudzi citi eksperimenti norādīja, ka elektromagnētiskais starojums uzvedās kā vilnis. No šiem eksperimentiem visspilgtākā bija difrakcija — fiziska parādība, kas novērota, kad vilnis saskaras ar šķērsli vai, pēc citas interpretācijas, viļņu spēja pārvarēt šķēršļus.
O Gaismas viļņu raksturs ir zināms kopš 1801. gada, kad angļu fiziķis Tomass Jangs ar spraugu apgaismoja barjeru. Kad gaisma iziet cauri šai spraugai, tā izkliedējas. Pie katras spraugas, ieskaitot to, ka gaisma iziet cauri, pat izkliedējot, tā iziet jaunu difrakciju.

Kā šis, bija jāpieņem jauna elektromagnētiskā starojuma uzvedība: viļņu daļiņu dualitāte. No turienes franču zinātnieks Louis de Broglie paplašināja šo jēdzienu, ierosinot, ka visas daļiņas ir jāsaprot arī kā tādas, kurām ir viļņu uzvedība.
De Broglija hipotēze nostiprinājās 1925. gadā, kad amerikāņu zinātnieki Klintons Deivissons un Lesters Germers pierādīja, ka elektronu stars spēj iziet difrakciju, ejot cauri vienam kristālam. niķelis.
Šī uztvere bija būtiska, lai nonāktu pie secinājuma, ka smagākas daļiņas, piemēram, molekulas, arī varēja iziet difrakciju un tādējādi uzrādīt viļņveidīgu uzvedību. Lai uzzinātu vairāk par viļņu daļiņu dualitāti, noklikšķiniet uz šeit.
nenoteiktības princips
Klasiskajā fizikā ir viegli noteikt daļiņas trajektoriju. Taču kvantu pasaulē, kurā arī daļiņas uzvedas kā viļņi, to trajektorija vairs nav tik precīza. Tas tāpēc, nav jēgas runāt par viļņa atrašanās vietu.
Piemēram, uz ģitāras, nospiežot stīgu, vilnis izplatās visā garumā. Ja daļiņai ir tāda pati uzvedība, nav iespējams precīzi noteikt tās atrašanās vietu zinot tā lineāro impulsu (daudzums, kas sajauc masu un ātrumu).
Tāpēc elektronam, kuram ir arī duāls raksturs, nav noteiktas orbītas/ceļa ap atoma kodolu, kā daudzi uzskata. Atad dualitāte rada nenoteiktību par daļiņas precīzu atrašanās vietu.
Šī nenoteiktība pozīcijas definīcijā ir niecīga ļoti smagiem ķermeņiem, bet pilnībā nozīmīga ķermeņiem ar atomu izmēru vai subatomisks, tas ir, ja jūs zināt, ka daļiņa atrodas noteiktā vietā, noteiktā brīdī, jūs vairs nezināt, kur tā būs nākamajā acumirklī.
No šīs dilemmas radās nenoteiktības princips., ko 1927. gadā izveidoja vācu fiziķis Verners Heizenbergs. Saskaņā ar šo principu nav iespējams zināt daļiņas pozīciju un lineāro impulsu bez kļūdas robežas, tas ir, ja viena īpašība ir zināma, otra nav. Lai uzzinātu vairāk par nenoteiktības principu, noklikšķiniet uz šeit.
Šrēdingera atomu modeļa iezīmes
Tā kā daļiņas divējāda rakstura dēļ tai vairs nebija iespējams noteikt konkrētu trajektoriju, austriešu zinātnieks Ervins 1927. Šrēdingers šo precīzo trajektoriju aizstāja ar viļņu funkciju, ko apzīmē grieķu burts psi (ψ), un šīs funkcijas vērtības mainās atkarībā no pozīcijas. Viļņu funkcijas piemērs ir sinusa funkcija x.
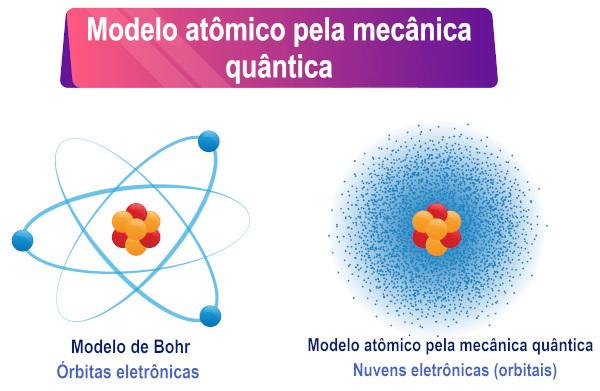
Pēc tam zinātnieks Makss Borns izveidoja viļņu funkcijas fizisku interpretāciju, norādot, ka funkcijas ψ kvadrāts, tas ir, ψ², būtu proporcionāls varbūtībai atrast daļiņu novads. Tādējādi ψ² tiek saprasts kā daļiņas atrašanas varbūtības blīvums kādā reģionā. Tā kā tas ir varbūtības blīvums, ψ² vērtība jāreizina ar tilpumu, lai iegūtu patieso varbūtību.
Lai aprēķinātu viļņu funkciju, Šrēdingers izstrādāja vienādojumu, vienkāršoti šādi:
Hψ = Eψ
Hψ ir jālasa kā “psi Hamiltona”, un tas apraksta viļņa funkcijas izliekumu. Hamiltons ir matemātisks operators, tāpat kā pluss, mīnuss, žurnāls utt. Labā puse mums atnes atbilstošu enerģiju.
Šī vienādojuma risinājums sniedz svarīgu secinājumu: daļiņām var būt tikai atsevišķa enerģijas, tas ir, labi noteiktas enerģijas vai kvantētas, nevis jebkura vērtība. Šīs īpašās enerģijas vērtības ir pazīstamas kā enerģijas līmeņi. Tas ir viļņu funkcijas uzlikšana, jo tai ir jāiekļaujas noteiktā telpas reģionā. Klasiskajā mehānikā objektam var būt jebkura kopējās enerģijas vērtība.
Kā šis, elektronam nevar būt nekādas enerģijas, bet labi definēti enerģijas līmeņi. Tā kā viļņu funkcijai ir jāatbilst telpas apgabalam, atcerieties, ka a elektrons ir ierobežots atoma iekšpusē caur pievilkšanās spēkiem, kas tai piemīt kodolam.
Atoma enerģijas līmeņus var aprēķināt, atbilstoši atrisinot Šrēdingera vienādojumu. Šajā gadījumā tiek pamanīts, ka izšķirtspēja sasniedz jaunu vienādojumu, kas parāda, ka katra atoma līmeņa enerģija ir atkarīga no vesela skaitļa, t.s. n, kas apstiprina domu, ka enerģijas līmeņiem ir noteiktas vērtības.
Tādējādi, piešķirot pozitīvas vērtības n (1, 2, 3...), ir iespējams aprēķināt atomu līmeņu enerģiju. Parametrs n tagad sauc par galveno kvantu skaitli, jo tas galu galā ir saistīts ar katru atoma līmeni, kas atļauts atomam.
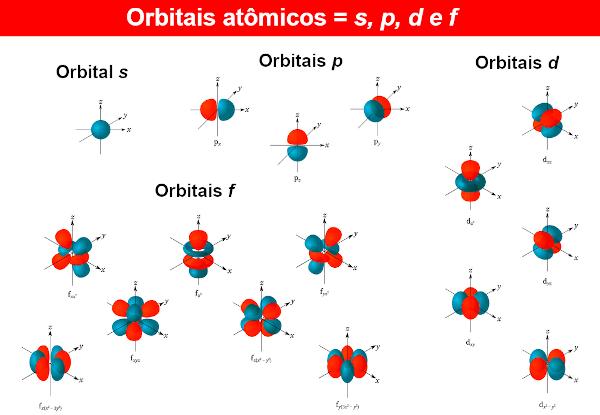
Uz elektronu viļņu funkcijas sauc par atomu orbitālēm, kuras matemātiskās izteiksmes iegūtas arī, atrisinot Šrēdingera vienādojumu. Atomu orbitāle parāda elektrona sadalījumu atomā, tas ir, elektrona esamības varbūtības reģionu atomā. Atomu orbitālēm var būt dažādas formas un enerģijas, kas iegūtas arī ar Šrēdingera vienādojumu.
Katram enerģijas līmenim n (Atceroties to n var būt 1, 2, 3...), ir n apakšlīmeņi. Katrā apakšlīmenī ir dažādas formas orbitāles. Dažādām orbitālēm nav ierobežojumu, taču ar līdz šim zināmajiem atomiem ķīmiķi izmanto tikai četrus no tiem, kurus identificē ar burtiem. s, P, d Tas ir f.
Tā, piemēram, līmenī n = 1, ir tikai viens apakšlīmenis, tātad ir tikai orbitāle s. Tagad par līmeni n = 2, ir divi apakšlīmeņi, kur atrodas orbitāles s Tas ir P.
Šrēdingera atomu modeļa sasniegumi attiecībā pret citiem atomu modeļiem
Kā minēts, Šrēdingers ne vienmēr iesniedza modeli, bet gan matemātisko interpretāciju. par novērotajām parādībām, kas attiecas uz daļiņu dabu. Tāpēc tā interpretācija kļūst sarežģīta, jo pašam Šrēdingera vienādojumam ir vajadzīgas progresīvas matemātiskās zināšanas, lai to atrisinātu un pat interpretētu.
Tomēr Šrēdingera pētījumi sniedza lielu izturību, lai attaisnotu atomu un elektronu enerģiju dāvanas. Piemēram, Šrēdingera vienādojuma izšķirtspēja apstiprina Bora atomu modeli ūdeņraža atomam un citiem hidrogenoīdu atomiem (tiem, kuriem ir tikai 1 elektrons). Tāpat kā Šrēdingers, Bors sasniedza ūdeņraža atomam pieļaujamos enerģijas līmeņus.
Tomēr Bora atomu modelis nespēj sasniegt elektroniskos līmeņus atomiem ar vairāk nekā 1 elektronu un tādējādi parāda savu galveno vājumu. Ja ir divi elektroni, ir jāņem vērā elektroniskā atgrūšanās starp tiem — parametrs, ko var pievienot Šrēdingera piedāvātajai matemātiskajai izpratnei.
Vēl viens svarīgs Šrēdingera pētījumu punkts ir kvantu jēdzienu pielāgošana, piemēram, daļiņas dualitāte, kā arī precīza elektrona trajektorija. Atomu orbitāles definīcija ir ļoti svarīga, lai izprastu visu atomu uzbūve. A varbūtības blīvums (ψ²) palīdz mums saprast, kā elektroni aizņem atomu orbitāles polielektroniskajos atomos, sniedzot precīzāku informāciju par elektrona enerģiju.
Autors Stefano Araujo Novais
Ķīmijas skolotājs
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/modelo-atomico-de-schrodinger.htm
