Matērijai var notikt divi galvenie pārveidošanas veidi - fizikālie un ķīmiskie. Fiziskā transformācija ir tad, kad matērijas daba, tas ir, tās sastāvs, netiek mainīts. Piemēram, kad mēs sagriezām koka gabalu, tas tika pārveidots, bet tā bija fiziska parādība, jo tas joprojām ir koks, tā uzbūve ir tāda pati kā sākumā.
No otras puses, ķīmiskā pārveidošanās vai parādība notiek, mainot vielas dabu vai sastāvu. Šajā gadījumā sākotnējās daļiņas (kas var būt molekulas, atomi, jonu kopas, joni utt.) Ir līdzīgas izjaukti un viņu atomi pārkārtojas, izveidojot jaunas molekulas, kopas, atomus, jonus utt., tas ir, jaunus vielas. Tas ir ķīmiskā reakcija.
Piemēram, iedomājieties, ka mēs tuvojam aizdedzinātu sērkociņu etilspirta tuvumā. Mēs zinām, kas notiks: alkohols sāks degt. Tas nozīmē, ka tajā notiek ķīmiskā reakcija ar skābekli gaisā (O2) un mainīs tā sastāvu, pārstājot būt etanols (C.2H6O), un arī skābeklim vairs nebūs sākotnējā sastāva, un tas radīs jaunas vielas, kas ir oglekļa dioksīds (CO2) un ūdeni (H2O).

Alkohols uz uguns - sadegšanas reakcija
Ķīmiskajās reakcijās tiek sauktas sākotnējās vielas reaģenti un beigas produktiem, un reakcijas tiek attēlotas caur ķīmiskie vienādojumi, kas atbilst šādai vispārējai struktūrai:
REAĢENTI → PRODUKTI
Ņemot vērā iepriekšējo pilnīgas spirta (etanola) sadegšanas reakcijas piemēru, mums ir šāds ķīmiskais vienādojums:
Etanols + skābekļa gāze → Oglekļa dioksīds + Ūdens
Šī ķīmiskā reakcija ir attēlota zemāk ar atomiem saskaņā ar Daltona modeli vienkāršu sfēru formā:
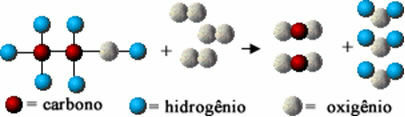
Etanola sadegšanas reakcijas modeļa attēlojums
Ievērojiet, ka sākotnējās saites starp atomiem bija pārrautas un tās izveidoja jaunas saites, un parādījās jaunas vielas.
Tādējādi ķīmiskos vienādojumus raksta, izmantojot formulas un simbolus, kas vislabāk atspoguļo iepriekš minēto shēmu. Aplūkotajā gadījumā (etanola sadedzināšanas reakcija) mums ir tas, ka ķīmiskais vienādojums tiek izteikts šādi:
Ç2H5ak(?) + 3 O2. punkta g) apakšpunkts → 2 CO2. punkta g) apakšpunkts + 3 H2Ov)
Ir daži vizuāli faktori, kas norāda, ka notika ķīmiska reakcija, un tie ir:
* Gāzes izdalīšana;
* Krāsas maiņa;
* Nogulšņu veidošanās;
* Liesmas vai spožuma izskats.
Svarīgi procesi, kas notiek mūsu ķermenī, dabā un rūpniecībā, piemēram, zāļu un rūpnieciski ražotu pārtikas produktu ražošana, ir ķīmiskas reakcijas. Tāpēc tie ir ārkārtīgi svarīgi dzīves rašanās un uzturēšanas nolūkos.
Ir vairāki ķīmisko reakciju veidi, kurus var klasificēt pēc dažādiem kritērijiem, taču galvenie ķīmijā pētītie veidi ir:
1. Neorganiskas reakcijas: Parasti tos klasificē pēc izveidoto vielu skaita, reaģentu skaita un vienkāršu un saliktu vielu klātbūtnes vai neesamības. Ir četri galvenie neorganisko reakciju veidi:
1.1. Sintēzes vai pievienošanas reakcijas;
1.2. Sadalīšanās vai analīzes reakcija;
1.3. Vienkārša apmaiņa, pārvietošana vai redoksreakcija;
1.4. Divkārša apmaiņa vai metatēzes reakcija;
2. Organiskās reakcijas: Tie ir tie, kas saistīti ar oglekļa savienojumiem. Tos parasti iedala trīs galvenajos veidos:
2.1. Papildinājumu reakcijas;
2.2. Aizstāšanas reakcijas;
2.3. Eliminācijas reakcijas.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-reacao-quimica.htm