A sublimācija Tās ir vielas fizikālā stāvokļa izmaiņas, ko raksturo tieša pāreja no cietās fāzes uz gāzveida fāzi, neizejot cauri šķidrajai fāzei. Stingri sakot, jebkura viela var tikt sublimēta, bet īpašos spiediena un temperatūras apstākļos. Sublimācija ir saistīta ar tvaika spiedienu cietajā fāzē, kā arī ar starpmolekulāro mijiedarbību, ko veic cietās vielas.
Šo procesu var viegli novērot sausā ledus gabalā, kas sastāv no cieta oglekļa dioksīda. Oglekļa dioksīds sublimējas zem spiediena un istabas temperatūrā. Sublimācijai pretēju procesu var saukt par resublimāciju vai nogulsnēšanos. Lai notiktu sublimācija, matērijai ir jāuzņem enerģija, tāpēc to uzskata par endotermisku procesu.
Izlasi arī: Kādi ir matērijas fizikālie stāvokļi?
Kopsavilkums par sublimāciju
Sublimācija ir tieša pāreja no cietās fāzes uz gāzveida fāzi, neizejot cauri šķidrajai fāzei.
Lai novērotu vielas sublimāciju, ir nepieciešami īpaši spiediena un temperatūras apstākļi.
Sublimāciju ietekmē termodinamiskie aspekti, piemēram, tvaika spiediens cietajā fāzē un starpmolekulārā mijiedarbība.
Sublimācija ir endotermisks process.
Sublimācijas piemērs ir tas, kas notiek sausajā ledū, kas sastāv no cieta oglekļa dioksīda.
Kas ir sublimācija?
sublimācija ir tieša pāreja no cietās fāzes uz gāzes fāzi, neizejot cauri šķidrajai fāzei. Dažām cietām vielām tas notiek īpašos temperatūras un spiediena apstākļos. Šī pāreja ir fizisks stāvokļa maiņas process, kas neietver ķīmiskas reakcijas.
Reverso procesu, t.i., tiešu pāreju no gāzveida fāzes uz cieto fāzi, sauc dažādi. Daži autori šai fāzes maiņai patur vārdu sublimācija, savukārt citi izmanto “resublimāciju” un pat “nogulsnēšanos”.
Kā darbojas sublimācija
Var vilkt paralēli starp sublimāciju un iztvaikošanu. Abos gadījumos galapunkts ir gāzes fāze. Atšķirība acīmredzami ir sākuma fāzē: cieta sublimācijai un šķidra iztvaicēšanai.
Abos gadījumos ir spiediena ietekme devapor un arī termodinamiskie aspekti, kas ietver siltuma un starpmolekulāro mijiedarbību.
Kas ir tvaika spiediens?
Slēgtā traukā, kurā ir šķidrums, ir iespējams uztvert, ka starp šķidro fāzi un tvaika fāzi ir līdzsvars. Tas notiek tāpēc, ka pat zem viršanas temperatūras esošā enerģija ir pietiekama, lai dažas šķidruma molekulas atdalītos un nonāktu tvaikos. Tomēr dažas tvaika molekulas var arī atkal kondensēties un atgriezties šķidrā fāzē, kas parāda procesa atgriezeniskumu.
Šis tvaiks ir izgatavots no viela (ir masa un tilpums), vingrinājumi spiediens uz šķidruma virsmu, kas pazīstams kā tvaika spiediens. Tas ir atkarīgs nevis no šķidruma daudzuma, bet no temperatūras, jo jo augstāka temperatūra, jo vieglāk molekulas atdalās no šķidrās fāzes.
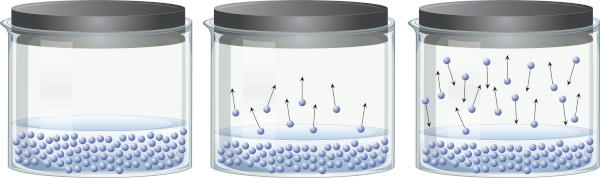
Šķidrumus, kuriem parastā temperatūrā ir augsts tvaika spiediens, sauc par gaistošiem. Piemēram, 25°C temperatūrā etilētera tvaika spiediens ir 0,58 atm, acetona (propanona) tvaika spiediens ir 0,29 atm, bet ūdens tvaika spiediens ir 0,023 atm. Starp citu, kad tvaika spiediens ir identisks atmosfēras spiedienam, šķidrums vārās. Lai uzzinātu vairāk par tvaika spiedienu, noklikšķiniet uz šeit.
Tvaika spiediens un sublimācija
Lai gan mazākā mērā, cietām vielām ir arī tvaika spiediens, bet daudz zemāks par šķidrumu. Piemēram, pat 1000 K temperatūrā dzelzs tvaika spiediens ir tikai 9,21 x 10-20 atm. Tomēr dažām cietām vielām, piemēram, jodam, izdodas sublimēties, radot augstāku tvaika spiedienu normālā temperatūrā (4 x 10-4 atm).
Tas ir iespējams tikai ar molekulu pāreju no cietā stāvokļa tieši uz gāzveida stāvokli. Lai tas notiktu, ir jāuzrāda cietās vielas molekulas starpmolekulārā mijiedarbība vājš (piemēram, jodā tie ir inducēta dipola izraisīta dipola tipa).
Ir arī redzams, ka sublimācijas process ir endotermisks, tas ir, ir nepieciešams, lai cietās vielas molekulas absorbētu enerģiju siltuma veidā, lai tās varētu pārtraukt starpmolekulāro mijiedarbību un pāriet uz tvaika stāvokli. Iesaistīto siltuma daudzumu var izmērīt ar termodinamisko lielumu, kas pazīstams kā sublimācijas entalpija.
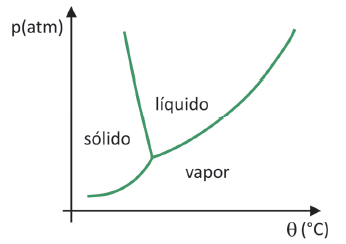
Fāžu diagramma
Uz zināt, kurā spiediena un temperatūras diapazonā notiks cietas vielas sublimācija, jums ir jānovērtē sava fāzes diagramma. Apskatīsim oglekļa dioksīda CO gadījumu2.

Fāzes diagrammā robežlīnijas starp stāvokļiem (ciets, šķidrums un gāze) apvieno spiediena un temperatūras vērtības notiek stāvokļa maiņa. Vērojot CO2 gadījumu, pamanāms, ka pie 1 atmosfēras spiediena cietā fāze pāriet tieši uz tvaika fāzi -78,5 °C temperatūrā, kas raksturo sublimāciju.
Oglekļa dioksīdam ir tikai šķidrā fāze spiedienā, kas pārsniedz 5,11 atmosfēras, un pēc šī spiediena sublimācija vairs nav iespējama. Lai uzzinātu vairāk par fāzes diagrammu, noklikšķiniet uz šeit.
sublimācijas piemēri
Sausais ledus: sausais ledus, ko bieži izmanto, lai radītu miglas efektus ballītēs un pasākumos, patiesībā ir oglekļa dioksīds cietā stāvoklī.

naftalīna: naftalīna bumbiņas ir izgatavotas no naftalīna, aromātiska organiska savienojuma. To lieto, lai noņemtu nepatīkamas smakas, kā arī atbaidītu kodes, tarakānus un citus indīgus dzīvniekus, tāpēc tos parasti izmanto skapjos vai pat pisuāros.

Kampars: Kampara oļi ar raksturīgu smaržu var arī sublimēties. Tie kalpo arī odu atbaidīšanai un pelējuma novēršanai.

Jods: nemetāls, kas pieder pie halogēniem, arī tiek sublimēts.

Tomēr starp piedāvātajām vielām Apkārtējās vides apstākļos sublimējas tikai oglekļa dioksīds. Pārējie, pat ar sublimāciju, var iziet normālu saplūšanu zem spiediena, kurā mēs dzīvojam.
Izlasi arī: Plazma - vielas ceturtais stāvoklis
Atrisināja vingrinājumus par sublimāciju
jautājums 1
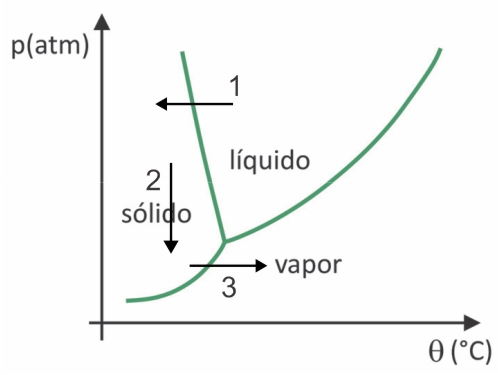
(Fuvest 2020) Lielveikalos ir ierasts atrast tā sauktos liofilizētos pārtikas produktus, piemēram, augļus, dārzeņus un gaļu. Liofilizētā pārtika joprojām ir piemērota patēriņam pēc ilga laika, pat bez ledusskapja. Termins “liofilizēts” šajos pārtikas produktos attiecas uz sasaldēšanas procesu un sekojošu dehidratāciju ar ūdens sublimāciju. Lai notiktu ūdens sublimācija, ir nepieciešama apstākļu kombinācija, kā parādīts spiediena un temperatūras grafikā, kur līnijas attēlo fāzu pārejas.
Neskatoties uz to, ka tas ir process, kas rūpnieciski prasa noteiktu tehnoloģiju izmantošanu, ir pierādījumi, ka cilvēki Pirmskolumbieši, kas dzīvoja Andu augstākajos reģionos, varēja liofilizēt pārtiku, ļaujot to uzglabāt vairāk laika. Pārbaudiet alternatīvu, kas izskaidro, kā notika dabiskais liofilizēšanas process:
a) Ūdens sublimācija notika zemās temperatūras un augsta atmosfēras spiediena dēļ kalnos.
b) Pārtika pēc dabiskās sasalšanas aukstajos periodos tika nogādāta kalnu zemākajā daļā, kur atmosfēras spiediens bija zemāks, kas padarīja iespējamu sublimāciju.
c) Pārtika tika pakļauta saulei, lai paaugstinātu temperatūru, un zemais vietējais atmosfēras spiediens veicināja sacietēšanu.
d) Aukstajos periodos temperatūra bija pietiekami zema, lai sasaldētu pārtiku, un zemais atmosfēras spiediens augstajos kalnos padarīja iespējamu sublimāciju.
e) Pārtikas produkti pēc dabiskās sasaldēšanas tika nospiesti, lai palielinātu spiedienu, lai varētu notikt sublimācija.
Atbilde: burts D.
Liofilizācijā notiek ūdens sasalšana ar sekojošu sublimāciju. Pirmskolumbiešu tautas varēja veikt šādu procesu, jo ziemā ūdens varēja sasalt (bultiņa 1) un ar zemu spiedienu (bultiņa 2) Andu augstākajos reģionos tas varētu sublimēties (bultiņa 3).
2. jautājums
(Uerj 2005) Sausais ledus jeb sacietējušais oglekļa dioksīds, ko plaši izmanto saldēšanas procesos, tiek pakļauts sublimācijai apkārtējās vides apstākļos. Šīs transformācijas laikā, cita starpā, notiek enerģijas variācijas un mijiedarbības traucējumi.
Šīs parādības attiecīgi klasificē šādi:
a) eksotermisks - interionisks
b) eksotermisks - starpkodolu
c) izotermisks - starpatomisks
d) endotermisks – starpmolekulārs
Atbilde: burts D.
Sublimācija ir endotermisks process, jo tam ir nepieciešama siltuma absorbcija, lai izjauktu mijiedarbību, kas saglabā cietās fāzes molekulas kompaktas. Šīs mijiedarbības ir starpmolekulārā tipa.
Autors Stefano Araujo Novais
Ķīmijas skolotājs

