THE hroms, atomskaitlis 24, ir pārejas metāls, kas atrodas periodiskās tabulas 6. grupā. Tā krāsa ir pelēcīga, taču tas ir arī ļoti spožs metāls. Tas galvenokārt eksistē +2, +3 un +6 oksidācijas stāvokļos, un tam piemīt īpašība, ka visi tā savienojumi ir krāsoti. Nav brīnums, ka tā nosaukums cēlies no grieķu valodas hroma, kas nozīmē krāsu.
Šo elementu iegūst, izmantojot hromītu, un plaši izmanto metalurģijas rūpniecībā, nerūsējošā tērauda un citu īpašu sakausējumu ražošanā. Hromu var arī galvanizēt uz objektiem, kas pazīstams kā hromēšana, kas papildus skaistumam garantē lielisku ķīmisko izturību. Papildus ugunsizturīgajiem materiāliem hroma savienojumus izmanto arī pigmentos un krāsās.
Izlasi arī: Hafnijs — pārejas metāls, kura īpašības ir līdzīgas cirkonija īpašībām
hroma kopsavilkums
Hroms ir pelēcīgs, spīdīgs metāls, kas atver 6. grupu Periodiskā tabula.
Tas ir ļoti izturīgs pret koroziju un ķīmisku iedarbību istabas temperatūrā.
Tam galvenokārt ir oksidācijas pakāpes +2, +3 un +6.
Visiem tā savienojumiem ir krāsa.
To var iegūt no hromīta, FeCr2THE4.
To galvenokārt izmanto metalurģijas rūpniecība, kas to izmanto ražošanā nerūsējošais tērauds.
To 1797. gadā atklāja francūzis Luiss Nikolass Vokelins.
[pullicity_omnia]
hroma īpašības
Simbols: Kr.
Atomu skaits: 24.
Atomu masa: 51,9961 c.u.s.
Elektronegativitāte: 1,66.
Sadales punkts: 1907°C.
Vārīšanās punkts: 2671°C.
Blīvums: 7,15 g.cm-3 (20°C temperatūrā).
Elektroniskā konfigurācija: [Gaiss] 4s1 3d5.
Ķīmiskā sērija: 6. grupa, metais pāreja.
hroma īpašības
Hroms, atoma numurs 24, ir a metāls pelēkā krāsā, ciets un spīdīgs. Istabas temperatūrā tas labi iztur ķīmiskus uzbrukumus, piemēram, no skābiem vai bāziskiem šķīdumiem, izņemot HCl un H2TIKAI4 atšķaidīts. Tomēr augstākā temperatūrā hroms kļūst daudz reaktīvāks, jo to viegli oksidē O2, un kombinējas ar halogēniem un lielāko daļu nemetālu.
Šķīdumā hroma savienojumiem parasti ir +6, +3 un +2 oksidācijas rādītāji. Patiesībā interesanta iezīme ir tā visi hroma savienojumi ir krāsaini, piemēram, dihromāts no kālijs, K2Kr2THE7, kas ir oranžs, un kālija hromāts, K2CrO4, kas ir dzeltens.
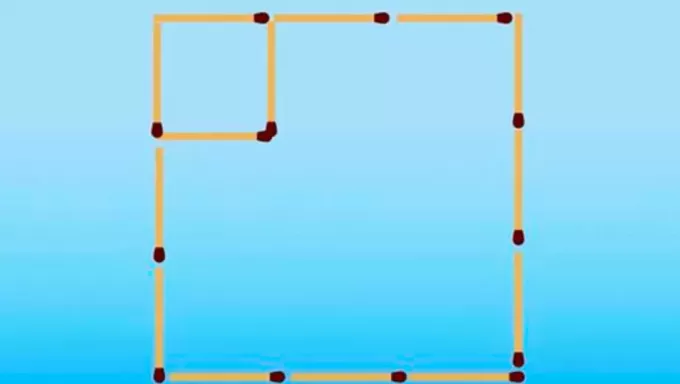
Interesants fakts par hromu ir tas tā elektronu konfigurācija neatbilst gaidītajam modelim. padarot jūsu elektroniskā izplatīšana, tas būtu paredzēts [Ar] 4s2 3d4, tomēr enerģijas un stabilitātes aprēķini liecina, ka [Ar] 4s konfigurācija1 3d5 tas ir stabilāks. To var izskaidrot ar Hunda noteikums.
Saskaņā ar šo noteikumu, jo lielāks skaits elektroni ar vienādiem (vai paralēliem) griezieniem nepilnā orbitālē, jo zemāka ir enerģija atoms, tas ir, jo lielāka ir stabilitāte. Apskatiet attēlu zemāk:

Ja hroms izmantoja 4s konfigurāciju2 3d4, 4s orbitāle radītu elektronus ar pretēju spinu (↑↓), kas palielinātu atgrūšanos, galu galā būtu divi vienas zīmes lādiņi, kuriem būtu viena orbitāle.
Pieņemot 4s konfigurāciju1 3d5, hroms satur lielāku skaitu elektronu ar vienādu spinu, bez elektronu klātbūtnes, kam ir viena orbitāle (kā parādīts iepriekšējā attēlā), kas samazina tā enerģiju un garantē lielāku stabilitāti.
Skatīt arī: Vanādijs — ķīmiskais elements, kura šķīdumiem arī ir dažādas krāsas
Kur var atrast hromu?
hroms ir desmitais visbiežāk sastopamais elements uz zemes. Lai gan ir vairāki minerāli, kuru sastāvā ir hroms, hromīts, FeCr2THE4, ir vissvarīgākais hroma minerāls, kas ir visplašāk komerciāli izmantotais.

Ir svarīgi uzsvērt, ka valstis ar vislielākajām hroma rezervēm ir:
Dienvidāfrika;
Kazahstāna;
Indija;
Turcija.
THE Brazīlija ir vienīgais hroma ražotājs visā Amerikas kontinentā, bet glabā tikai 0,11% no pasaules rezervēm. Rezerves galvenokārt tiek sadalītas šādos stāvokļos:
Bahia;
amapá;
Minas Žeraiss.
Hroma iegūšana

THE tiek ražots metālisks hroms cauri no hromīta. Šajā gadījumā minerāls tiek izkausēts ar nātrija karbonāts, plkst2CO3, gaisa klātbūtnē, radot nātrija hromātu un dzelzs III oksīdu:
4 FeCr2THE4 + 8 collas2CO3 + 7 O2 → 8 collas2CrO4 + 2 Fe2THE3 + 8 CO2
No turienes ekstrakcija tiek veikta ar Ūdens, kopš Na2CrO4 šķīst ūdenī, savukārt Fe2THE3 nē. Pēc tam barotni paskābina ar H2TIKAI4, kas ļauj kristalizēt hromātu no nātrijs. na2CrO4 tiek reducēts līdz hroma III oksīdam, izmantojot ogleklis augstā temperatūrā:
Plkst2CrO4 + 2 C → Kr2THE3 + ieslēgts2CO3 + CO
Metāliskais hroms tiek iegūts, ja alumīniju izmanto kā reducētāju, arī augstā temperatūrā:
Kr2THE3 + 2 Al → Al2THE3 + 2 Kr
hroma lietojumprogrammas
THE nozare metalurģijas ir lielākais hroma patērētājs, un aptuveni 80% no visa saražotā hroma hromīta vai Cr koncentrāta veidā.2THE3. Tas ir tāpēc, ka hroms spēj veidot ferohroma sakausējumu, kas ir galvenais iegūšanas avots. nerūsējošais tērauds un citi īpaši sakausējumi.
Hroms, kas parasti veido 18% no nerūsējošā tērauda, ievērojami palielina izturību pret oksidāciju (koroziju) un citiem ķīmiskiem uzbrukumiem tēraudam. Citos īpašos sakausējumos hromam ir nozīme arī materiālu sacietēšanas, cietības un stingrības paaugstināšanā.

THE ugunsizturīgo rūpniecību Tas ir arī labs hroma patērētājs, jo hromīts ir labi zināms ugunsizturīgs materiāls, tas ir, materiāls, kas spēj izturēt termisko, ķīmisko un fizisko ietekmi, kas rodas rūpniecībā. Hromīts, ko izmanto ugunsizturīgo ķieģeļu ražošanai, ir ļoti izturīgs pret noārdīšanos, ja tas tiek pakļauts karsēšanai.
jau ķīmiskā rūpniecība cenšas izmantot hromu vairākos veidos:
kā katalizators;
kā korozijas inhibitors;
hroma pārklājumā;
pigmentos;
krāsošanas maisījumos.
Hromēšana ir labi zināma, un tā sastāv no hroma aizsargslāņa veidošanās virs objekta, pasargājot to no korozijas. Šajā procesā hroms tiek uzklāts uz hromējamā objekta elektrolīze hroma III sulfāts, Kr2(TIKAI4)3, kas iegūts, izšķīdinot Cr2THE3 in H2TIKAI4.
Hroma pigmenti ir ļoti izplatīti, īpaši ar dažādām krāsām, ko var iegūt ar to savienojumiem. Izšķīdinot hroma III hlorīda heksahidrātu, CrCl3·6 no rīta2O, iegūst violetu šķīdumu. No otras puses, hroma III sulfāta šķīdināšanā Kr2(TIKAI4)3, tiek iegūta zaļa krāsa.
Hroma II hlorīda CrCl šķīdums2, ir zils, savukārt hroma II acetāts, Cr2(DŪDOT)4, ir sarkana cieta viela. Hroma oksīds II, CrO2, tas ir melns; kālija hromāts, K2CrO4, un dzeltens; kālija dihromāts, K2Kr2THE7, un apelsīnu; kālija trihromāts, K2Kr3THE10, tas ir sarkans; un hroma VI oksīds, CrO3, ir arī sarkans.
Interesanti:Rubīni patiesībā ir dārgakmeņi, kuru formula ir Al2THE3, kuru sastāvā ir hroma pēdas. Tas attiecas arī uz smaragdu, berila formu, kura zaļā krāsa ir neliela hroma daudzuma rezultāts.
Zināt arī:Volframs — pelēcīgs metāls, kura krāsa atgādina tēraudu
Chromium saistība ar veselību
Diviem hroma oksidācijas stāvokļiem ir bioloģiskā nozīme. Skatīsimies tālāk.
→ Sešvērtīgais hroms (Cr6+)
Attiecībā uz Kr6+, zināms, ka tā var būt uzskatīts par kancerogēnu, īpaši, ja tas tiek ieelpots vai norīts lielos daudzumos.
→ Trīsvērtīgais hroms (Cr3+)
Trīsvērtīgais hroms vienmēr ir bijis apsvērts būtisks elements. Uztura bagātinātājs ar hromu šajā formā ir kļuvis populārs būtisku mikroelementu veicināšanai un kā svara zaudēšanas līdzeklis. Ir arī diskusija, ka trīsvērtīgā hroma ievadīšana būtu interesanta ārstēšanai 2. tipa cukura diabēts, kā arī gestācijas diabēta gadījumā.
Lai gan, daži autori liek šī apspriežamā būtība. Domas virziens ir tāds, ka hroms neatkarīgi no tā, vai tas ir vai nav papildināts, neietekmē ķermeņa uzbūvi, vielmaiņa dod glikoze vai jutība pret insulīnu. Tiek uzskatīts, ka patiesībā lielākajai hroma devai ir farmakoloģiska un ar uzturu nesaistīta ietekme, kas norāda uz to kā būtisku elementu.
hroma vēsture
Nosaukums hroms cēlies no grieķu valodas hroma, kas nozīmē krāsu. Piešķirot arī nosaukumu šim elementam, notika tā atklājumsFranču farmaceits un ķīmiķis Luiss Nikolass Vokelins, 1797. gadā, kad viņš pamanīja hromu, pētot krokoīta rūdu, PbCrO4. Tomēr sākotnēji metāls neguva milzīgus komerciālus panākumus.
Piemēram, piecpadsmit gadus pēc tā atklāšanas sers Hamfrijs Deivijs, rakstot savu slaveno grāmatu, neko daudz nezināja par hromu un tā savienojumiem. Ķīmiskās filozofijas elementi, norādot tikai to, ka hromskābei bija skāba garša.
Tajā pašā gadā Jöns Jacob Berzelius rakstīja, ka toksiskās hromskābes pēcgarša ir nepatīkama un metāliska. Bērzeliuss saprata, ka metāls, lai arī trausls, ir diezgan izturīgs pret darbību skābes un atmosfēras gaiss.
Lai gan sākotnēji tas nebija milzīgs komerciāls panākums, 19. gadsimta beigās un 20. gadsimta sākumā, elements sāka izmantot komerciāli, jo sāka plaši izmantot nerūsējošo tēraudu, kā arī detaļu hromēšanu automobiļu rūpniecībā, padarot hromu par ļoti pieprasītu metālu.
Hroma atrisināti vingrinājumi
jautājums 1
(UEFS/BA)Hroma atoma oksidācijas koeficients sugā ir +3
A) Kr2THE3
B) CrO
C) Kr
D) CrO42-
E) Kr2THE72-
Izšķirtspēja:
Alternatīva A
Burtā C hroms parādās kā vienkārša viela, tāpēc tādā gadījumā NOx ir vienāds ar nulli.
THE skābeklis pārējos savienojumos tas notiek ar NOx, kas vienāds ar -2. Tādējādi mēs varam aprēķināt hroma NOx visās sugās, padarot to par nezināmu (x):
Kr2THE3 → 2x + 3(-2) = 0 ⸫ x = +3
CrO → x + (-2) = 0 ⸫ x = +2
CrO42- → x + 4(-2) = -2 ⸫ x = +6
Cr2O72- → 2x + 7(-2) = -2 ⸫ x = +6
2. jautājums
(UPE 2013) Starptautiska zinātnieku grupa ir atklājusi sarežģītu ķīmisku reakciju, kas izraisa dažu no lieliski mākslas darbi vēsturē, ko veidojis Vincents van Gogs (1853–1890) un citi slaveni gleznotāji 20. gs. XIX. Savos pētījumos šie pētnieki mākslīgi novecoja pigmentus un atklāja, ka virsējā slāņa tumšums bija saistīts ar krāsā esošā hroma maiņu no Cr(VI) uz Cr(III).
Pieejams: http://agencia.fapesp.br/13455 (pielāgots)
Dati:Cr (Z = 24), elektroniskā konfigurācija: [Ar] 4s1 3d5
Ņemot vērā iepriekš aprakstīto situāciju, tā ir PAREIZIapgalvot, ka ()
A) Cr(VI) oksidēšanās par Cr(III) ir pasliktinājusi lielus mākslas darbus vēsturē.
B) kadru novecošana ir saistīta ar Cu elektronisko ierosmiThe par Kr3+.
C) Cr samazināšanas process6+ par Kr3+ ir aizēnojusi slavenus 19. gadsimta darbus.
D) notikusī transformācija ir oksidējusi CuThe, kas atbild par oriģinālās gleznas spīdumu.
E) maiņa no Cr(VI) uz Cr(III) ir ķīmiska reakcija, kas notiek tikai pēc daudziem gadiem.
Izšķirtspēja:
Alternatīva C
Pāreja no Cr(VI) uz Cr(III) ir process, kurā samazināšana (NOx samazinājums), kas bija atbildīgs par ekrānu aptumšošanu.
Autors Stefano Araújo Novais
Ķīmijas skolotājs