Viens polārais savienojums (vai viela) ir tāds, kuram ir divi apgabali ar dažādu elektronu blīvumu. Vienam no šiem reģioniem ir pozitīvs raksturs (baltais laukums), bet citam ir negatīvs raksturs (dzeltenais laukums), kā redzams šādā attēlojumā:

Dažāda lādiņa apgabalu attēlojums polārā savienojumā
Zināt, ja kāds kompozīts ir polārs nozīmē, ka ir jāzina starpmolekulārā spēka veids, kas veicina mijiedarbību starp tā molekulām vai ar citu vielu molekulas, kā arī izdarot pieņēmumus par to šķīdību un kušanas temperatūru un vārot.
Piemēram: attiecībā uz šķīdību polārajiem savienojumiem ir laba spēja izšķīst polāros savienojumos. Runājot par starpmolekulāriem spēkiem, atkarībā no gadījuma polārie savienojumi var mijiedarboties ar spēkiem pastāvīgās dipola vai ūdeņraža saites (stiprums, kas rada arī augstākus kušanas punktus un vārīšana).
Šeit ir divi praktiski veidi, kā noteikt, vai savienojums ir vai nav polārs.
Polaritātes noteikšana caur mākoņu skaitu un ligandu skaitu
Mēs varam noteikt, vai a kompozīts ir polārs
pēc attiecības starp centrālajam atomam piesaistīto vienādu atomu skaitu un elektronu mākoņu skaitu šajā centrālajā atomā.Piezīme: Elektronu mākonis ir jebkura ķīmiska saite starp diviem atomiem vai elektronu pāris no atoma valences apvalka, kas nepiedalās saitē.
Ja mākoņu skaits centrālajā atomā atšķiras no vienādu ligandu skaita šajā centrālajā atomā, mums ir polārs savienojums. Lai labāk izprastu, izpildiet tālāk sniegtos piemērus.
1. piemērs: Ciānūdeņražskābes molekula
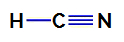
Ciānūdeņražskābes strukturālā formula
Ciānūdeņražskābes centrālais atoms ir ogleklis, kurā ir četri elektroni valences slānis par piederību periodiskās tabulas IVA saimei. Kā ogleklis veido vienotu saiti (dalot divus elektronus ar vienu elektronu no katra atoma iesaistīts) ar ūdeņradi un trīskāršo saiti ar slāpekli, tāpēc atomā nav nesaistošu elektronu centrālais.
Tādējādi ciānūdeņražskābē ir divi elektroniski mākoņi (viena saite un trīskāršā saite) un ligands, kas ir vienāds ar otru. Tāpēc tas ir a polārais savienojums.
2. piemērs: Amonjaka molekula (NH3)
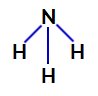
Amonjaka strukturālā formula
Amonjakā centrālais atoms ir slāpeklis, kura valences apvalkā ir pieci elektroni, jo tas pieder periodiskās tabulas VA saimei. Tā kā slāpeklis veido vienotu saiti (dalās divi elektroni, ar vienu elektronu katrs iesaistītais atoms) ar katru ūdeņraža atomu divi no pieciem tā elektroniem nepiedalās saitēs.
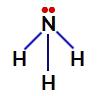
Slāpekli nesaistoši elektroni amonjakā
Tādējādi amonjakā ir četri elektronu mākoņi (trīs atsevišķas saites un nesaistošais elektronu pāris) un trīs vienādi ligandi (trīs ūdeņraži). Tātad tas ir a polārais savienojums.
Nepārtrauciet tagad... Pēc reklāmas ir vēl kas ;)
Polaritātes noteikšana caur savienojuma dipola momenta vektoru
Mēs varam noteikt, vai a kompozīts ir polārs veicot analīzi iegūtais dipola momenta vektors tās strukturālajā formulā, ņemot vērā tās molekulārā ģeometrija un atšķirība elektronegativitāte starp iesaistītajiem atomiem.
Piezīme: Elementu elektronegativitātes dilstošā secībā: F > O > N > Cl > Br > I > S > C > P > H.
Ja molekulā esošo vektoru summa atšķiras no nulles, savienojums būs polārs. Lai labāk izprastu, rīkojieties šādi:
1. piemērs: trihlormetāna molekula
Trihlormetāns ir savienojums, kas parādās tetraedriskā ģeometrija, kā mēs redzam tās strukturālajā formulā zemāk:

Trihlormetāna strukturālā formula
Lai noskaidrotu, vai tas ir vai nav polārs savienojums, vispirms ir jāievieto dipola momenta vektori (bultiņas, kas norāda, kurš atoms ir stabilāks par otru), kā parādīts šajā piemērā:
Piezīme: Hlors ir elektronnegatīvāks elements nekā ogleklis. Savukārt ogleklis ir elektronnegatīvāks elements nekā ūdeņradis.
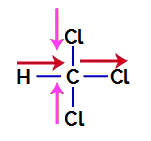
Dipola momenta vektori trihlormetānā
Rozā krāsas vektorus var attēlot ar +x un -x, jo tiem ir vienāds virziens (vertikāls) un pretēji virzieni (augšup un lejup). Sarkanā krāsā esošie vektori tiek attēloti ar +x, jo tiem ir viens un tas pats virziens. Tādējādi iegūto dipola momenta vektoru (vektoru summu) attēlo:
μr = (+x) + (-x) + (+x) + (+x)
μr = +X – x + x + x
μr = 2x
Tā kā iegūtais dipola momenta vektors nav nulle, mums ir a polārais savienojums.
2. piemērs: ūdens molekula
Ūdens ir savienojums, kas parādās leņķiskā ģeometrija, kā mēs redzam tās strukturālajā formulā zemāk:
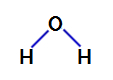
Ūdens strukturālā formula
Lai noskaidrotu, vai tas ir vai nav polārs savienojums, sākotnēji struktūrā jāievieto dipola momenta vektori (bultiņas, kas norāda, kurš atoms ir stabilāks par otru), kā parādīts zemāk:
Piezīme: Skābeklis ir elektronnegatīvāks elements nekā ūdeņradis.
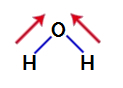
dipola momenta vektori ūdenī
Tā kā divi ūdens struktūras vektori ir pa diagonāli šķērsām, mums jāizmanto paralelograma noteikums. Šajā noteikumā, kad mēs saistām vektoru bāzes, mēs izveidojam iegūto vektoru (kas aizstāj divus iepriekš izmantotos), kā tas ir šajā modelī:
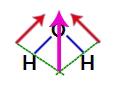
Iegūtais vektors ūdens strukturālajā formulā
Tā kā ūdens molekulai ir viens vektors, iegūtais dipola momenta vektors nav nulle, tas ir, mums ir polārais savienojums.
Es. Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu kādā skolā vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Kas ir polārais savienojums?"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm. Skatīts 2021. gada 27. jūlijā.