Plkst oksidācijas reakcijas ar sekundārajiem spirtiem ir tie, kuros mijiedarbība starp organisko savienojumu no grupas spirti, kam jābūt sekundāram, un tā sauktajam Bayer reaģentam (KMnO4) skābā vidē.
Ikreiz, kad Bayer reaģents atrodas skābā vidē (aq/H+), tajā notiek sadalīšanās reakcija, iegūstot kālija oksīdu, mangāna oksīdu II un topošos skābekli, kā redzams šajā vienādojumā:
2 kmnO4 (ūdens/H+) → 2 MnO + K2O + 5 [O]
Jebkurā oksidācijas reakcijā, topošie skābekli, kas radušies, sadaloties kālija permanganātam skābā vidē, uzbrūk oglekļa ķēdēm kuriem ir pi saites starp oglekli (alkāniem, alkīniem un alkadiēniem) vai kuras ir slēgtas (ciklāni, aromātiskie ciklēni), radot jaunus ķīmiskus savienojumus.
Gadījumā, ja oksidācijas reakcija sekundārajos spirtos, pirms izprast reakcijas mehānismu, ir jāatceras sekundārā spirta jēdziens. tiek saukts sekundārais alkohols tāds, kurā hidroksilgrupa (OH) ir saistīta ar a sekundārais ogleklis (ogleklis ir tieši saistīts ar diviem citiem oglekļa atomiem). Skatiet sekundārā spirta attēlu:
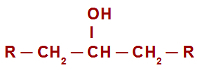
Sekundārā spirta vispārīgā strukturālā formula
Katrā oksidācijas reakcijā spirtos topošie skābekļi uzbrūk ūdeņražiem, kas atrodas uz oglekļa, kurā ir hidroksilgrupa. Oksidācijas reakciju gadījumā sekundārajos spirtos katrā šāda veida spirta struktūrā skābekļiem ir tikai viens ūdeņraža atoms, kam uzbrukt.
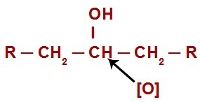
Topošais skābeklis, kas uzbrūk sekundārajam spirtam
Uzbrūkot ūdeņradim (H), kas atrodas hidroksilgrupā (OH), topošais skābeklis ([O]) veido jaunu hidroksilgrupu. uz tā paša oglekļa. Tātad mums ir gemino diols cietumā. Tā kā geminodiols (HO – C – OH) ir nestabils, tas sadalās ūdens molekulā.Tomēr starp oglekli un skābekli, kas paliek pāri no viena no hidroksilgrupām, veidojas dubultā saite (pi un sigma).
Nepārtrauciet tagad... Pēc reklāmas ir vēl kas ;)
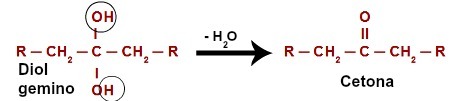
Sekundārā spirta oksidācijas ķīmiskais vienādojums
Produkts, kas radies sekundāro spirtu oksidācijas reakcijā, vienmēr ir a ketonu, jo dubultsaite vienmēr veidojas pie sekundārā oglekļa, kā rezultātā starp diviem oglekļa atomiem veidojas karbonilgrupa, tādējādi veidojot ketonu.
Skatīt tagad a Oksidācijas reakcijas piemērs sekundārajos spirtos.
Piemērs: Butān-2-ols
O butān-2-ols ir sekundārs spirts, jo hidroksilgrupa ir saistīta ar sekundāro oglekļa atomu. Tātad uz oglekli, kurā ir hidroksilgrupa, ir tikai viens ūdeņradis. Mēs varam pārbaudīt šo faktu zemāk esošajā struktūrā:

Pakļaujot barotnei, kas satur ūdeni, skābi un KMnO4 (Bayer reaģents), jūsu ūdeņradim uzbrūk topošais skābeklis, pārvēršoties par jaunu hidroksilu, kā rezultātā veidojas geminodiols.

Visbeidzot, notiek divu geminodiolā esošo hidroksilgrupu sadalīšanās, tādējādi rodas ūdens molekula un ketons, jo ir jāizveido saite starp oglekli un vienu no sadalīto hidroksilu skābekli.

mēs varam pārstāvēt visa butān-2-ola oksidācijas reakcija ar šādu vienādojumu:

Es. Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu kādā skolā vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Oksidācijas reakcijas sekundārajos spirtos"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/reacoes-oxidacao-alcoois-secundarios.htm. Skatīts 2021. gada 27. jūlijā.
Ķīmija

Hidroksilfunkcionālā grupa, primārie spirti, sekundārie spirti, terciārie spirti, metanols, glicerīns, etanols, nitroglicerīna ražošana, krāsu ražošana, alkoholisko dzērienu ražošana, etiķskābe, degviela automašīnām.


