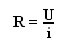Oglekļa valences apvalkā ir četri elektroni, kas nozīmē, ka tas var veidot četras saites, tādējādi var pievienoties citiem atomiem. kā: H, O, N, Cl. Šī oglekļa īpašība izskaidro dabā esošo organisko savienojumu daudzveidību, tāpēc tiek teikts, ka ogleklis ir četrvērtīgs.
1874. gadā Van’t Hoff un Le Bel izveidoja oglekļa telpisko modeli. Šādam modelim oglekļa atomi bija attēloti ar regulāriem tetraedriem, un ogleklis aizņem tetraedra centru un tā četras valences atbilst tā četrām virsotnēm.

Oglekļa telpiskā formula.
Šajā modelī dažādie saišu veidi, kas rodas starp oglekļa atomiem, tika attēloti šādi:
) vienkārša saite - tetraedrus savieno virsotne (viena saite);


b) dubultā saite - tetraedrus savieno divas virsotnes (mala);


c) Trīskāršā saite - tetraedrus savieno trīs virsotnes (viena skaldne);


Atomu modeļa attīstība parādīja, ka atomam ir kodols un elektrosfēra, kas ļāva parādīties jauniem modeļiem izskaidrot oglekļa veidotās saites: 1915. gadā Lūiss nāca klajā ar jaunu priekšlikumu atomu savienošanai. ogleklis. Pēc Lūisa teiktā, atomi valences slānī savienojās caur elektroniskiem pāriem. Šo attēlojumu sauca par Lūisa elektronisko formulu, un saites veids, kurā atomi savienojas caur elektroniskiem pāriem, ir pazīstams kā kovalentā saite.

Lūisa elektroniskā formula
Lielākā daļa organisko molekulu ir trīsdimensiju, tāpēc ir jāizmanto modeļi, kas parāda ne tikai struktūru, bet arī ģeometriju. Tāpēc telpiskā formula ir piemērotāka oglekļa struktūras izpratnei.
Autore Līrija Alvesa
Beidzis ķīmiju
Brazīlijas skolas komanda
Organiskā ķīmija - Ķīmija - Brazīlijas skola
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/formulas-estruturais-carbono.htm