Nitrāti ir neorganiski savienojumi, kas satur anjonu NO3-.
Slāpeklis ir 15. saime, valences apvalkā ir 5 elektroni, un tam ir jāizveido trīs kovalentās saites (ar elektronu koplietošanu), lai valences apvalkā būtu astoņi elektroni un tādējādi būtu stabils. Tomēr katra skābekļa pēdējā apvalkā ir 6 elektroni, un tāpēc katram tā atomam ir jāizveido divas saites, lai tas būtu stabils.
Tātad nitrātu anjonā slāpeklis ir centrālais elements, kas veido dubultsaiti ar vienu no skābekļa atomiem, kas ir stabila, viena saite ar vienu no diviem pārējiem skābekļa atomiem un ar otru kovalentā saite datīvs. Tas nozīmē, ka viens no skābekļa atomiem nav stabils, un tam ir jāsaņem vēl 1 elektrons, kas nodrošina kopējo lādiņu, kas vienāds ar -1. Ar datīvo slāpekli veido saiti vairāk, nekā tas varētu, ziedojot vienu no saviem elektroniem, iegūstot lādiņu, kas vienāds ar +1. Skatiet tālāk šī anjona struktūru:

Šis anjons var uztvert elektronu un veidot elektriski neitrālu savienojumu, neorganisku sāli. Visi šie savienojumi šķīst ūdenī.
Galvenie nitrātu lietojumi ir medikamenti, piemēram, vazodilatatori, lai ārstētu stenokardiju (sāpes ko izraisa zema skābekļa piegāde ar asins plūsmu sirds muskulī) un erektilā disfunkcija vīrietis. Tos izmanto arī mēslošanas līdzekļos un sprāgstvielās, kā tas tiks minēts vēlāk.
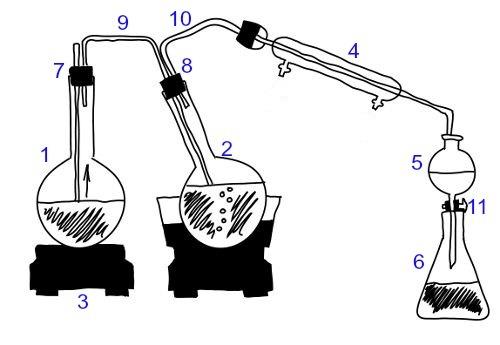
Nitrātus var iegūt slāpekļskābes (HNO) neitralizēšanas reakcijā.3) ar zināmu pamatojumu. Skatiet tālāk redzamo piemēru, kur veidojās magnija nitrāts:
HNO3 + Mg(OH)2 → Mg (NO3)2+ H2O
Trīs galvenie šāda veida savienojumu piemēri ir nātrija nitrāts (NaNO3), kālija nitrāts (KNO3) un amonija nitrātu (NH4PIE3). Visos šajos gadījumos katjoni (Na+,K+ un NH4+) nodrošina 1 elektronu nitrātu anjonam. Bet patiesībā šie pretējie lādiņi piesaista viens otru un veido skaidri noteiktas jonu kopas, kas ir kristāla režģi. Tādējādi nitrāti parasti ir kristāliskas cietas vielas, kā parādīts tālāk nātrija nitrāta gadījumā:

Šo savienojumu izmanto mēslošanas līdzekļu ražošanā, bet galvenokārt to sauc par Čīles salpetrs, jo Čīles tuksnešos ir lielas tā atradnes. Tas tiek pārveidots par kālija nitrātu, no kura tiek izgatavots melnais pulveris, ko izmanto dažādos ieročos un sprāgstvielās.

Gan nātrija nitrātu, gan kālija nitrātu sauc par "salpetru", ko plaši izmanto kā gaļas konservu un kūpinājumu krāsas konservanti, kā arī dažos pārtikas produktos, lai nodrošinātu lielāku gaļas sajūtu sāta sajūtu. Taču tā lietošana nodara nopietnu kaitējumu veselībai, jo šos nitrātus var pārveidot baktērijas no organisms pārvēršas nitrītos un vēlāk nitrozamīnos, kas ir kancerogēni, galvenokārt izraisot vēzi vēders. Nitrīti arī pārvērš hemoglobīnu asinīs, padarot tos nespējīgus pārnēsāt skābekli.
Galvenie pārmērīgas nitrātu uzņemšanas cēloņi ir slāpekļa mēslošanas līdzekļu izmantošana dārzeņu audzēšanā.
Salpetrs ir arī bīstams, jo palielina nātrija jonu koncentrāciju organismā, kas var izraisīt sirds problēmas, piemēram, paaugstinātu asinsspiedienu.
O amonija nitrāts to izmanto arī kā mēslojumu un sprāgstvielu, un to pat izmantoja kopā ar mazutu teroristu uzbrukumā Pasaules tirdzniecības centra ēkām 2001. gada 11. septembrī.

Uzbrukumā Pasaules tirdzniecības centram tika izmantots amonija nitrāts*
* Attēla autortiesības: Dens Hovels un Shutterstock.com
Autore: Dženifera Fogača
Beidzis ķīmiju