Plkst degšanas reakcijas tie ir sastopami daudzos mūsu ikdienas dzīves aspektos. Piemēram, galvenie enerģijas avoti rodas, sadedzinot vai sadedzinot noteiktu kurināmo, piemēram, etanolu, benzīnu, kokogles utt. Turklāt enerģija, kas mums nepieciešama, lai izdzīvotu un strādātu, ir sadegšanas reakciju rezultāts, kas notiek mūsu šūnās, kad mēs “sadedzinām” pārtiku, ko ēdam.
Bet kas nepieciešams, lai notiktu degšanas reakcija?
Nepieciešamas trīs lietas:
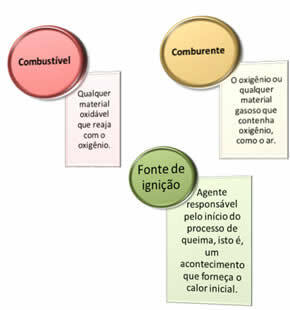
Šie trīs faktori veido uguns trīsstūris, jo, tiklīdz sākas sadegšanas reakcija, atbrīvotā enerģija uztur reakciju un ļauj tai turpināties, līdz pazūd degviela, oksidētājs vai siltums (atbrīvotā enerģija). Tas nozīmē, ka būs a Ķēdes reakcija.
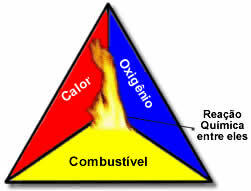
Piemēram, ja kāds mežā izmet aizdedzinātu cigareti, izcelsies ugunsgrēks (degšanas reakcija). Šajā gadījumā, Bušs tas ir degviela, O gaisā esošais skābeklis atmosfēra ir oksidētājs tas ir cigarete iedegta bija aizdegšanās avots. Šī degšana turpināsies, līdz tiks novērsts viens no trim faktoriem. Ja ugunsdzēsēji iemetīs ūdeni, karstums tiks likvidēts. Bet pat tad, ja nekas netiks darīts, lai šo degšanu apturētu, tā kaut kad beigsies, tas ir, kad beigsies degviela (mežs).
Kā jau minēts, šajās reakcijās izdalās siltums, līdz ar to degšana ir eksotermiska reakcija. Tomēr šāda veida reakcija ir nepilnīga sadegšana. Lai saprastu, kāpēc, skatiet atšķirību starp pilnīgu un nepilnīgu sadegšanu:
Pilnīga sadegšana:
Analizējot organiskos savienojumus kā kurināmo, mums ir:
| THE pilnīga sadegšana tas notiks, kad oglekļa ķēde ir pārrauta un visi oglekļa atomi oglekļa ķēdē ir pilnībā oksidēti. |
| Tu veidoti produkti ogļūdeņraži būs CO2 (oglekļa dioksīds) un H2O (Ūdens). |
Ievērojiet izooktāna pilnīgu sadegšanu, kas ir viena no benzīna sastāvdaļām.
Ç8H18(g) +25/2 O2 g → 8 CO2(g) + 9 stundas2O(1)
nepilnīga sadegšana
| Šajā gadījumā nav pietiekami daudz oksidētāja, tas ir, pietiekami daudz skābekļa, lai sadedzinātu visu degvielu. |
| Tādējādi izveidotie produkti ir CO (oglekļa monoksīds) un H2O. |
Novērojiet to pašu izoktāna sadegšanu, taču tagad nepilnīgi:
Ç8H18(g) + 17/2 O2(g) → 8 CO (g) + 9 stundas2O(1)
Piemērs ir mežu dedzināšana, jo radītās emisijas sastāv no CO un konkrētām vielām, piemēram, sodrējiem (C), kā arī pelniem un citiem vienkāršiem un sarežģītiem organiskiem savienojumiem. Slāpekļa oksīds, ozons un aldehīdi var veidoties arī sekundāro reakciju rezultātā citu sastāvdaļu klātbūtnes dēļ gaisā.
Ç8H18(g) + 9/2 O2 g → 8C (g) + 9 stundas2O(1)
Autore: Dženifera Fogača
Beidzis ķīmiju
Brazīlijas skolas komanda
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm

