Starp starpmolekulārajiem spēkiem, inducētie dipola izraisītie dipola spēki tās ir vienīgās, kuras nav pētījis holandiešu fiziķis Johanness Dīderiks Van der Vāls (1837-1923). Tos noskaidroja vācu fiziķis Frics Volfgangs Londons (1900-1954), tāpēc šos spēkus sauc arī Londonas spēki vai Londonas izkliedes spēki. Vēl viens šiem spēkiem dotais nosaukums ir momentānais dipola izraisīts dipols.
Šāda veida spēks rodas nepolāras vielas, piemēram, H2, O2, F2, Cl2, CO2, CH4 un C2H6, cita starpā. Un tie var rasties arī starp cēlgāzes atomi, kad tie tuvojas, izraisot atgrūšanos starp to elektrosfērām. Tādā veidā elektroni uzkrājas noteiktā pusē, kas ir negatīvi polarizēta un pretējā pusē pozitīvi, negatīvā lādiņa deficīta dēļ.
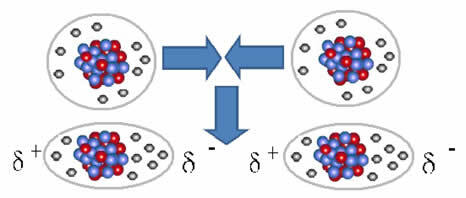
Nepolārās molekulas var pāriet no gāzveida stāvokļa, kurā tās atrodas ļoti tālu viena no otras un nav mijiedarbības, jo nav polu, uz šķidru un cietu stāvokli. Šajos agregācijas stāvokļos molekulas atrodas tuvāk un elektroniskās pievilcības vai atgrūšanās starp to elektroniem un kodoli var īslaicīgi izraisīt elektronisko mākoņu deformāciju, radot pozitīvus un negatīvus polus pagaidu.
Momentāni dipoli var izraisīt blakus esošo molekulu polarizāciju, kā rezultātā rodas pievilcīgi spēki.
Nepārtrauciet tagad... Pēc reklāmas ir vēl kas ;)
Šī indukcija var notikt arī. starp dažādām molekulām un vispār šiem spēkiem ir vājāka intensitāte nekā dipola-dipola un ūdeņraža saites stiprības. Tāpēc cietās vielas ar šādu mijiedarbības stiprumu, piemēram, sausais ledus (oglekļa dioksīds - CO2) un jods (I2), kas atrodas cietā stāvoklī, ir cildenas (pāriet uz gāzveida stāvokli); jo enerģija, kas nepieciešama, lai izjauktu viņu mijiedarbību, ir maza.
Starpmolekulāro spēku piemērs starp polārajām un nepolārajām molekulām ir starp skābekļa gāzi (nepolāru) un ūdeni (polāru). Izrādās, ka ūdens negatīvais gals tuvojas O2, atgrūžot sevi, un tādējādi nepolārās molekulas elektroniskais mākonis attālinās. Pēc tam skābeklis uz brīdi tiek polarizēts un sāk mijiedarboties ar ūdeni, izšķīdinot tajā.
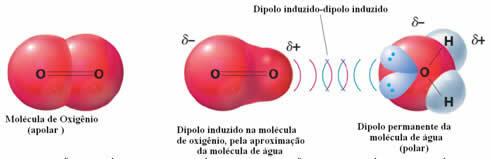
Tā kā šie spēki ir vāji, šīs gāzes šķīdība ūdenī ir maza. Pat ja tā ir, tā klātbūtne ir būtiska, lai saglabātu dažādu ūdens organismu dzīvi.
Šis mijiedarbības spēks rodas arī dabā, nodrošinot saķeri starp gekonu ķepām un virsmu, pa kuru tie staigā. Tāpēc viņi var staigāt pa sienām un griestiem, nenokrītot un nelīpoties.
Autore: Dženifera Fogača
Beidzis ķīmiju
Brazīlijas skolas komanda
Vai vēlaties atsaukties uz šo tekstu kādā skolā vai akadēmiskajā darbā? Skaties:
FOGAÇA, Dženifera Roča Vargasa. "Inducēti dipola izraisīti dipola vai Londonas dispersijas spēki"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/forcas-dipolo-induzido-dipolo-induzido-ou-dispersao-london.htm. Skatīts 2021. gada 27. jūlijā.



