Iztvaicēšana tā ir pāreja no šķidruma uz gāzveida stāvokli. Tas notiek uz šķidrumu brīvās virsmas, lēnām un pakāpeniski, jebkurā temperatūrā.
Kad viela atrodas šķidrā stāvoklī, tai ir mazāks kohēzijas spēks starp atomiem nekā cietā stāvoklī.
Šajā stāvoklī molekulas atrodas tālāk viena no otras, pastāvīgi maisot un pārvietojoties šķidruma iekšienē ar dažādu ātrumu.
Tādā veidā daļiņām ar lielāku ātrumu, sasniedzot šķidruma brīvo virsmu, izdodas izkļūt, pārejot gāzveida stāvoklī.

Iztvaikošanas ātrums
Ir faktori, kas ietekmē iztvaikošanas ātrumu, un tie ir:
- Temperatūra: jo augstāka temperatūra, jo lielāks iztvaikošanas ātrums. Jo augstāka temperatūra, jo augstāka kinētiskā enerģija no daļiņām. Tādā veidā no šķidruma virsmas izkļūs vairāk daļiņu.
- Šķidruma veids: ir vielas, kuras iztvaiko vieglāk, tās sauc par gaistošām vielām. Ēteris, alkohols un acetons ir gaistošo vielu piemēri.
- brīvas virsmas laukums: tā kā iztvaikošana notiek uz šķidrumu brīvās virsmas, jo lielāka ir virsma, jo lielāks ir daļiņu daudzums, kas atstās šķidrumu.
- Tvaiku koncentrācija šķidrumā: jo lielāks tvaika daudzums, jo mazāks iztvaikošanas ātrums.
- Spiediens uz šķidrumu: jo lielāks spiediens, jo mazāks iztvaikošanas ātrums.
Starpība starp iztvaikošanu un vārīšanos
Gan iztvaikošana, gan vārīšanās ir pāreja no šķidrā stāvokļa uz gāzveida stāvokli. Lai gan iztvaikošana notiek pakāpeniski, vārīšanās notiek ātri.
Lai vārīšanās notiktu, šķidrumam, sasniedzot noteiktu spiedienu, jāsasniedz noteikta temperatūra, ko sauc par viršanas temperatūru. Iztvaikošana var notikt jebkurā temperatūrā.
Maisījumu atdalīšana
Daļēja kristalizācija ir heterogēnu maisījumu atdalīšanas process. To lieto, ja vielas, kas veido maisījumu, ir cietā stāvoklī.
Šajā procesā maisījumam pievieno šķidrumu, kas izšķīdina visus cietos komponentus. Pēc tam komponenti pēc šķīduma iztvaikošanas atsevišķi kristalizējas.
Šo procesu izmanto, piemēram, sāls pannās, lai iegūtu sāļus no jūras ūdens.

Iztvaicēšana un ūdens cikls
Iztvaikošana ir viens no procesiem, kas veido ūdens cikls. Saules enerģija silda ezeru, upju, jūru un okeānu brīvo virsmu.
Šīs sildīšanas rezultātā daļa ūdens iztvaiko tvaika stāvoklī. Tas, sasniedzot augstākos atmosfēras slāņus, atdziest un kondensējas, veidojot mākoņus.
Kad notiek nokrišņi, ūdens šķidrā veidā atgriežas uz virsmas, iefiltrējoties augsnē un veidojot pazemes loksnes.
Daļu no šī ūdens absorbē augi, kas ūdens tvaikus atgriežas atmosfērā, veicot pārelpošanu.
fāzes izmaiņas
Parasti tiek saukta pāreja no šķidruma uz gāzveida stāvokli iztvaicēšana, jo tas papildus iztvaikošanai ietver divus citus procesus: vārīšanu un karsēšanu.
Joprojām ir citi stāvokļa maiņas procesi. Vai viņi:
- Kodolsintēze
- Sacietēšana
- Sašķidrināšana vai kondensācija
- Sublimācija
Zemāk redzamajā diagrammā mēs attēlojam trīs matērijas fiziskie stāvokļi un attiecīgās stāvokļa izmaiņas:
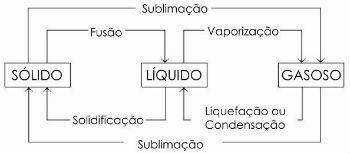
Uzziniet vairāk vietnē: Fiziskā stāvokļa izmaiņas.