Ķīmiskais izomērijs ir parādība, ko novēro, kad divām vai vairākām organiskām vielām ir vienāda molekulārā formula, bet atšķirīga molekulārā struktūra un īpašības.
Ķīmiskās vielas ar šīm īpašībām sauc par izomēriem.
Šis termins ir atvasināts no grieķu vārdiem iso = vienāds un tikai = daļas, tas ir, vienādas daļas.
Izomērijai ir dažādi veidi:
- plakans izomērs: Savienojumus identificē ar plakanām strukturālām formulām. Tas ir sadalīts ķēdes izomērijā, funkcijas izomērijā, pozīcijas izomērijā, kompensācijas izomerismā un tautomērisma izomērijā.
- kosmosa izomērs: Savienojumu molekulārajai struktūrai ir atšķirīga telpiskā struktūra. Tas ir sadalīts ģeometriskajā un optiskajā izomērijā.
plakans izomērs
Plkst plakana izomērija vai konstitucionālais izomērijs, organisko vielu molekulārā struktūra ir plakana.
Savienojumus, kuriem piemīt šī īpašība, sauc par plakanajiem izomēriem.
ķēdes izomērs
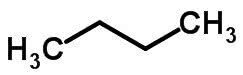
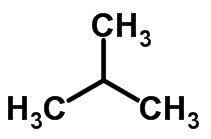
Ķēdes izomērija notiek, ja oglekļa atomiem ir dažādas ķēdes un viena un tā pati ķīmiskā funkcija.
Piemēri:
Funkcijas izomērija
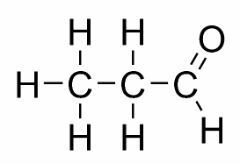
Funkcijas izomērija rodas, ja diviem vai vairākiem savienojumiem ir dažādas ķīmiskās funkcijas un viena un tā pati molekulārā formula.
Piemēri: Šis gadījums ir izplatīts starp aldehīdiem un ketoniem.
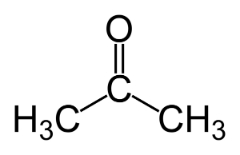
Pozīcijas izomērs
Pozīcijas izomērija rodas, ja savienojumus diferencē oglekļa ķēdē ar dažādu nepiesātinājumu, sazarojumu vai funkcionālo grupu pozīcijām. Šajā gadījumā izomēriem ir tāda pati ķīmiskā funkcija.
Piemēri:

kompensējošais izomērs
Kompensācijas izomērisms vai metamerisms rodas savienojumos ar tādu pašu ķīmisko funkciju, kas atšķiras pēc heteroatomu stāvokļa.
Piemēri:

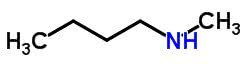
Tautomērija
Tautomerismu vai dinamisko izomēriju var uzskatīt par specifisku funkcionālā izomērija gadījumu. Šajā gadījumā viens izomērs var mainīties uz citu, mainot elementa stāvokli ķēdē.
Piemēri:

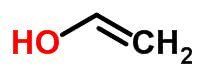
kosmosa izomērs
kosmosa izomērija, ko sauc arī par stereoizomerismu, notiek, ja diviem savienojumiem ir vienāda molekulārā formula un dažādas strukturālās formulas.
Šāda veida izomērijā atomi tiek sadalīti vienādi, bet telpā tie aizņem dažādas pozīcijas.
ģeometriskais izomērs
ģeometriskais izomērijs vai cis-trans notiek nepiesātinātās vaļējās ķēdēs un arī cikliskos savienojumos. Lai to izdarītu, oglekļa ligandiem jābūt atšķirīgiem.

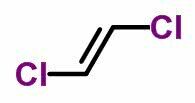
- Kad vieni un tie paši ligandi atrodas vienā un tajā pašā pusē, izomēru nomenklatūra saņem prefiksu cis.
- Kad vieni un tie paši ligandi atrodas pretējās pusēs, nomenklatūra saņem prefiksu tulk.
IUPAC (Starptautiskā tīrās un lietišķās ķīmijas savienība) iesaka cis un trans vietā kā prefiksu izmantot burtus Z un E.
Tas ir tāpēc, ka Z ir vācu vārda pirmais burts zusammen, kas nozīmē "kopā". Un tas ir vācu vārda pirmais burts entegegen, kas nozīmē "pretējs".
optiskais izomērs
optiskais izomērijs pierāda savienojumi, kas ir optiski aktīvi. Tas notiek, ja vielu izraisa leņķiskā novirze polarizētās gaismas plaknē.
- Kad viela saliek optisko gaismu pa labi, to sauc labo roku.
- Kad viela saliek optisko gaismu pa kreisi, viela tiek saukta levorotārs.
Viela var pastāvēt arī divās optiski aktīvās formās - dekstogrāra un levogira. Šajā gadījumā to sauc enantiomērs.
Lai oglekļa savienojums būtu optiski aktīvs, tam jābūt kirālam. Tas nozīmē, ka viņu ligandi nevar pārklāties, jo tie ir asimetriski.
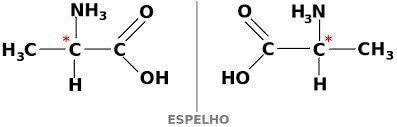
Savukārt, ja savienojumam vienādās daļās ir dekstrogiras un levorotārās formas, tos sauc racēmiskie maisījumi. Racēmisko maisījumu optiskā aktivitāte ir neaktīva.
Lasiet arī:
- Ogleklis
- Organiskā ķīmija
- Molekulārā formula
- strukturālā formula
Vingrinājumi
1. (Mackenzie 2012) Skaitļu B kolonna, kas satur organiskus savienojumus, saistot tos ar A kolonnu, atbilstoši katras organiskās molekulas izomērijas tipam.
A kolonna
1. kompensējošais izomērs
2. ģeometriskais izomērs
3. ķēdes izomērs
4. optiskais izomērs
B kolonna
() ciklopropāns
() etoksi-etāns
() bromhlorfluormetāns
() 1,2-dihloretēns
Pareiza skaitļu secība B slejā no augšas uz leju ir
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
B) alternatīva 3 - 1 - 4 - 2.
2. (Uerj) Izomērija ir parādība, ko raksturo fakts, ka viena un tā pati molekulārā formula pārstāv dažādas struktūras.
Ņemot vērā plakano strukturālo izomēru molekulārajai formulai C4H8, mēs varam identificēt šādus izomērus:
a) ķēde un novietojums
b) ķēde un funkcija
c) funkcija un kompensācija
d) amats un kompensācija
Alternatīva a) virkne un novietojums
3. (OSEC) Propanons un izopropenols ir izomērijas gadījums:
a) no metamērijas
b) funkcijas
c) tautomērijas
d) cis-tran
e) ķēde
Tautomērijas c) alternatīva
Skatiet arī: Vingrinājumi par plakanu izomēriju