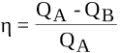Termodinamika ir fizikas joma, kas pēta enerģijas pārneses. Tas cenšas izprast attiecības starp siltumu, enerģiju un darbu, analizējot apmainītā siltuma daudzumu un fiziskajā procesā veikto darbu.
Termodinamisko zinātni sākotnēji izstrādāja pētnieki, kuri rūpnieciskās revolūcijas periodā meklēja veidu, kā uzlabot mašīnas, uzlabojot to efektivitāti.
Šīs zināšanas šobrīd tiek izmantotas dažādās mūsu ikdienas situācijās. Piemēram: termiskās mašīnas un ledusskapji, automašīnu dzinēji un procesi minerālu un naftas produktu pārveidošanai.
Termodinamikas likumi
Termodinamikas pamatlikumi nosaka, kā siltums kļūst par darbu, un otrādi.
Pirmais termodinamikas likums
Pirmais termodinamikas likums attiecas uz enerģijas taupīšanas princips. Tas nozīmē, ka enerģiju sistēmā nevar iznīcināt vai radīt, tikai pārveidot.
Formula, kas apzīmē pirmo termodinamikas likumu, ir šāda:

Siltuma daudzumam, darbam un iekšējās enerģijas variācijām kā standarta mērvienība ir Džouls (J).
Praktisks enerģijas taupīšanas piemērs ir gadījums, kad cilvēks ar sūkni piepūšamā priekšmeta uzpūšanai izmanto spēku, lai gaisu iesūknētu objektā. Tas nozīmē, ka kinētiskā enerģija virzuļam nolaižas. Tomēr daļa no šīs enerģijas tiek pārveidota par siltumu, kas tiek zaudēts videi.
Hesa likums ir īpašs enerģijas taupīšanas principa gadījums. Uzziniet vairāk!
Otrais termodinamikas likums
Plkst siltuma pārneses tie vienmēr notiek no siltākā ķermeņa līdz aukstākajam ķermenim, tas notiek spontāni, bet ne otrādi. Tas nozīmē, ka siltumenerģijas pārneses procesi ir neatgriezeniski.
Tādā veidā Otrais termodinamikas likums, nav iespējams siltumu pilnībā pārveidot par citu enerģijas veidu. Šī iemesla dēļ siltums tiek uzskatīts par degradētu enerģijas veidu.

Fizikālais daudzums, kas saistīts ar otro termodinamikas likumu, ir entropija, kas atbilst sistēmas traucējumu pakāpei.
Lasiet arī:
- Carnot cikls
- Termiska izplešanās
Nulles termodinamikas likums
Nulles termodinamikas likums attiecas uz nosacījumiem, lai iegūtu siltuma bilance. Starp šiem apstākļiem mēs varam pieminēt tādu materiālu ietekmi, kas padara siltuma vadītspēju lielāku vai zemāku.
Saskaņā ar šo likumu
- ja ķermenis A atrodas termiskā līdzsvara stāvoklī saskarē ar ķermeni B un
- ja šis ķermenis A atrodas termiskā līdzsvara stāvoklī saskarē ar ķermeni C, tad
- B ir siltuma līdzsvarā, saskaroties ar C.
Saskaroties diviem ķermeņiem ar dažādu temperatūru, tas, kurš ir siltāks, pārnes siltumu uz to, kas ir vēsāks. Tas izraisa temperatūras izlīdzināšanos, sasniedzot siltuma bilance.
To sauc par nulles likumu, jo tā izpratne izrādījās nepieciešama pirmajiem diviem jau pastāvošajiem likumiem, pirmajam un otrajam termodinamikas likumam.
Trešais termodinamikas likums
Trešais termodinamikas likums tas parādās kā mēģinājums izveidot absolūtu atskaites punktu, kas nosaka entropiju. Entropija faktiski ir otrā termodinamikas likuma pamatā.
To ierosinājis fiziķis Valters Nernsts secināja, ka nav iespējams, ka tīrai vielai ar nulles temperatūru ir entropija ar aptuvenu nulles vērtību.
Šī iemesla dēļ tas ir pretrunīgi vērtēts likums, ko daudzi fiziķi uzskata par likumu, nevis likumu.
termodinamiskās sistēmas
Termodinamiskā sistēmā var būt viens vai vairāki saistīti ķermeņi. Vide, kas to ieskauj, un Visums attēlo sistēmu ārpus sistēmas. Sistēmu var definēt kā: atvērtu, slēgtu vai izolētu.
 termodinamiskās sistēmas
termodinamiskās sistēmas
Atverot sistēmu, starp sistēmu un ārējo vidi notiek masas un enerģijas pārnese. Slēgtajā sistēmā notiek tikai enerģijas pārnese (siltums), un, kad tā ir izolēta, nav apmaiņas.
gāzu uzvedība
Gāzu mikroskopiskā uzvedība ir vieglāk aprakstāma un interpretējama nekā citos fizikālos stāvokļos (šķidrā un cietā stāvoklī). Tāpēc šajos pētījumos visvairāk tiek izmantotas gāzes.
Termodinamiskos pētījumos tiek izmantotas ideālas vai ideālas gāzes. Tas ir modelis, kurā daļiņas pārvietojas haotiski un mijiedarbojas tikai sadursmēs. Turklāt tiek uzskatīts, ka šīs sadursmes starp daļiņām, starp tām un tvertnes sienām ir elastīgas un ilgst ļoti īsu laiku.
Slēgtā sistēmā ideāla gāze paredz uzvedību, kas ietver šādus fiziskos lielumus: spiedienu, tilpumu un temperatūru. Šie mainīgie nosaka gāzes termodinamisko stāvokli.
 Gāzu uzvedība saskaņā ar gāzes likumiem
Gāzu uzvedība saskaņā ar gāzes likumiem
Spiedienu (p) rada gāzes daļiņu kustība trauka iekšpusē. Tvertnes iekšpusē esošā gāze aizņem tilpumu (v). Un temperatūra (t) ir saistīta ar kustīgo gāzes daļiņu vidējo kinētisko enerģiju.
Lasīt arī Gāzes likums un Gāzu izpēte.
iekšējā enerģija
Sistēmas iekšējā enerģija ir fizisks lielums, kas palīdz izmērīt, kā notiek gāzes pārvērtības. Šis lielums ir saistīts ar daļiņu temperatūras un kinētiskās enerģijas izmaiņām.
Ideālai gāzei, kas sastāv tikai no viena veida atoma, iekšējā enerģija ir tieši proporcionāla gāzes temperatūrai. To attēlo šāda formula:

Atrisināti vingrinājumi par termodinamiku
jautājums 1
Cilindrā ar kustīgu virzuli ir gāze ar spiedienu 4.0.104N / m2. Kad sistēmai tiek piegādāts 6 kJ siltuma, pie pastāvīga spiediena gāzes tilpums palielinās par 1,0.10-1m3. Nosakiet paveikto darbu un iekšējās enerģijas izmaiņas šajā situācijā.
Pareiza atbilde: paveiktais darbs ir 4000 J, un iekšējās enerģijas izmaiņas ir 2000 J.
Dati:
P = 4,0.104 N / m2
J = 6KJ vai 6000J
ΔV = 1,0.10-1 m3
T =? ΔU =?
1. solis: Aprēķiniet darbu ar problēmas datiem.
T = P. ΔV
T = 4.0.104. 1,0.10-1
T = 4000 J
2. solis: Aprēķiniet iekšējās enerģijas variāciju ar jaunajiem datiem.
Q = T + ΔU
ΔU = Q - T
ΔU = 6000 - 4000
ΔU = 2000J
Tāpēc veiktais darbs ir 4000 J, un iekšējās enerģijas izmaiņas ir 2000 J.
2. jautājums
(Pielāgots no ENEM 2011) Motors darbu var veikt tikai tad, ja tas saņem enerģijas daudzumu no citas sistēmas. Šajā gadījumā degvielā uzkrāto enerģiju degšanas laikā daļēji atbrīvo, lai ierīce varētu darboties. Kad motors darbojas, daļu no enerģijas, kas pārveidota vai pārveidota degšanas laikā, nevar izmantot darba veikšanai. Tas nozīmē, ka pastāv enerģijas noplūde citā formā.
Saskaņā ar tekstu enerģijas pārveidošanās, kas notiek motora darbības laikā, ir saistīta ar:
a) nav iespējams atbrīvot siltumu motora iekšpusē.
b) motora veiktais darbs nav kontrolējams.
c) nav iespējams pilnībā pārveidot siltumu par darbu.
d) siltuma enerģijas pārveidošana kinētikā nav iespējama.
e) degvielas potenciālā enerģijas izmantošana nav kontrolējama.
Pareiza alternatīva: c) nav iespējams pilnībā pārveidot siltumu par darbu.
Kā redzams iepriekš, siltumu nevar pilnībā pārveidot par darbu. Motora darbības laikā tiek zaudēta daļa siltumenerģijas, kas tiek pārnesta uz ārējo vidi.
Skatiet arī: Vingrinājumi par termodinamiku