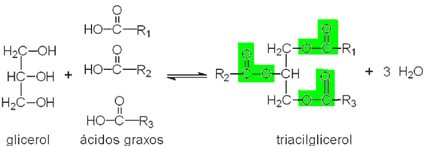
Atoms ir matērijas pamatvienība un mazākā frakcija, kas spēj identificēt ķīmisko elementu, jo tam ir identitāte. Termins atoms cēlies no grieķu valodas un nozīmē nedalāmu.
Tas sastāv no kodola, kurā ir neitroni un protoni, un elektroni, kas ieskauj kodolu.
atomu struktūra
Atomu veido mazas daļiņas, ko sauc arī par subatomiskās daļiņass: elektroni, protoni un neitroni.
Lielākā daļa atoma masas ir koncentrēta kodolā, mazā, blīvā reģionā. Tās lielākais tilpums atrodas elektrosfērā, tukšu vietu vietā, kad elektroni riņķo ap kodolu.
elektroni
O elektrons tam ir negatīvs elektriskais lādiņš (-1) un gandrīz nav masas, jo tā vērtība ir 9,11 x 10-28 g un ir aptuveni 1840 reizes mazāka par serdes masu. Tās ir sīkas daļiņas, kas ļoti ātri griežas ap atoma kodolu.
Elektroni, kas atrodas atoma attālākajos reģionos, ir atbildīgi par ķīmisko saišu veidošanos, kas rodas, ziedojot, saņemot vai daloties ar elektroniem.
protoni
O protons tam ir pozitīvs elektriskais lādiņš (+1) ar tādu pašu absolūto vērtību kā lādiņš uz elektroniem. Tādā veidā protons un elektrons mēdz elektriski piesaistīt viens otru.
Caur protoniem ir iespējams atšķirt ķīmiskos elementus, jo katra elementa atoma kodolā ir noteikts protonu skaits, ko sauc par atomu skaitlis.
neitroni
O neitronu tam vispār nav maksas, tas ir, tas ir elektriski neitrāls. Kopā ar protoniem tas veido atoma kodolu, kas nes visu atoma masu (99,9%). Gan protona, gan neitrona masa ir aptuveni 1,67 x 10-24 g. Šī vērtība apzīmē 1 μ atomu masas vienību.
Neitrons nodrošina stabilitāti atoma kodolam, jo kodolspēks liek to piesaistīt elektroniem un protoniem.
Tikai ūdeņraža atomā nav neitronu, to veido tikai elektrons, kas griežas ap protonu.
Pārbaudiet zemāk esošo tabulu abstrakts ar informāciju par subatomiskām daļiņām.
| Daļiņa | Simbols |
Makaroni (vienībās atomu masa) |
Uzlādējiet (vienībās elektriskā lādiņa - u.c.e) |
Atrašanās vieta |
|---|---|---|---|---|
| Protons | +1 | kodols | ||
| Neitrons | 0 | kodols | ||
| Elektrons | -1 | elektrosfēra |
Atoms pamatstāvoklī ir elektriski neitrāls, jo protonu skaits ir vienāds ar elektronu skaitu un pretējie pozitīvie un negatīvie lādiņi viens otru atceļ.
Piemēram, nātrijam (Na) ir atomu skaitlis 11, tas ir, tā kodolā ir 11 protoni. Līdz ar to šī elementa atoma elektrosfērā ir 11 elektroni.
Lasiet vairāk par atomu struktūra.
atomu sastāvs
Kā redzējām, atomu veido mazs un blīvs centrālais reģions, ko sauc par kodolu, un ap to ir elektrosfēra, kur atrodas elektroni, kurus var sadalīt elektroniskajos slāņos, enerģijas apakšlīmeņos un atomu orbitāles.
elektroniskie slāņi
atoms uzrāda enerģijas līmenis, kas atbilst septiņiem slāņiem ap kodolu un tajos ir elektroni, kas riņķo ap to. Slāņus sauc par K, L, M, N, O, P un Q.
Katrā apvalkā var būt noteikts skaits elektronu, kā parādīts zemāk esošajā tabulā.
| Enerģijas līmenis | elektroniskais slānis | Maksimālais elektronu skaits |
|---|---|---|
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | J | 8 |
Piemēram, hēlija atomam (He) ir atoma skaitlis 2, un tāpēc kodolā ir 2 protoni. Līdz ar to atoma elektrosfērā ir tikai 2 elektroni, kas atrodas atoma pirmajā un vienīgajā elektroniskajā apvalkā - K apvalkā, kas atbilst pirmajam enerģijas līmenim.
Enerģijas apakšlīmeņi
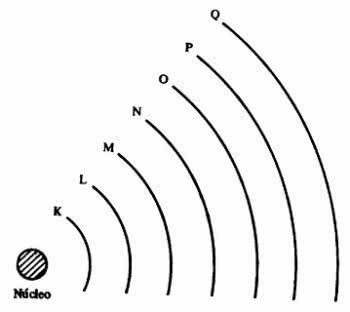
Enerģijas līmeņos atrodas apakšlīmeņi, kurus attēlo s, p, d, f. Katrā apakšlīmenī ietilpst maksimālais elektronu skaits, kas attiecīgi ir 2, 6, 10 un 14.

Izmantojot šo informāciju, ir iespējams elektroniskais sadalījums un zināt attālākā un enerģētiskākā elektrona atrašanās vietu.
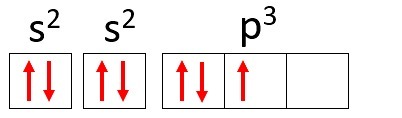
Piemērs: Slāpeklis (N)
Atomu skaits: 7
Elektroniskā izplatīšana: 1s2 2s2 2. lpp3
Slāpekļa atomam ir divi enerģijas līmeņi - K un L, un tā 7 elektroni aizņem s un p apakšlīnijas.
K: s2 = 2 elektroni
L: s2 + lpp3 = 5 elektroni
Ņemiet vērā, ka L apvalkā var būt līdz pat 8 elektroniem, bet slāpekļa atomā šajā apvalkā ir tikai 5 elektroni.
atomu orbitāles
Orbītas raksturo reģionu, kas, visticamāk, atradīs elektronu enerģijas apakšlīmenī (s, p, d, f) elektroniskajā apvalkā (K, L, M, N, O, P, Q).
- s apakšlīmenis: ir 1 orbitāle, kas satur līdz 2 elektroniem
- p apakšlīmenis: ir 3 orbitāles, kurās atrodas līdz 6 elektroniem
- D apakšlīmenī ir 5 orbitāles, kurās atrodas līdz 10 elektroniem
- F apakšlīmenī ir 7 orbitāles, kurās atrodas līdz 14 elektroniem
Vēlreiz izmantojot slāpekli kā piemēru un sadalot tā 7 elektronus atomu orbitālēs, mums būtu:
Atomu veidi
Novērojot protonu, neitronu un elektronu skaitu, mēs varam salīdzināt atomus un klasificēt tos izotopi, izobāri un izotoni.
Ķīmisko elementu var definēt kā atomu grupu ar vienādu protonu skaitu. Šos atomus sauc par izotopiem, jo tiem ir vienāds atomu skaits un dažādas masas.
Piemēram, dabā ir 3 ūdeņraža (H) elementa izotopi: protium , deitērijs
un tritijs
.
Dažādu ķīmisko elementu atomus var klasificēt kā izotonus, ja tiem ir atšķirīgs atomu skaits un masa, bet vienāds neitronu skaits.
Izobāri ir dažādu elementu atomi, tas ir, tiem ir atšķirīgs atomu skaitlis, bet vienāds masas skaitlis.
Lasiet vairāk par izotopi, izobāri un izotoni.
Atomu modeļi (atomu modeļi)
Grieķu filozofs Aristotelis (384 a. Ç. - 322 a. C) mēģināja izskaidrot visu vielu sastāvu no elementiem zemes, gaisa, uguns un ūdens.
Demokrits (546 a. C - 460 a. C), grieķu zinātnieks un matemātiķis, formulēja domu, ka daļiņu mazumam ir robeža. Viņš teica, ka viņi kļūs tik mazi, ka tos vairs nevarēs sadalīt. Viņš nosauca šo daļiņu par “atomu”.
Lielāko daļu 19. gadsimta tas bija Daltona atomu modelis, Angļu zinātnieks, kurš ierosināja atomu teoriju, kas tālu pārsniedza seno cilvēku domas.
Šī teorija teica, ka visas vielas veido mazas nedalāmas daļiņas, kuras sauc par atomiem, kas būtu kā biljarda bumbiņas. Kad materiāla struktūras pētījumi attīstījās, tika atklāts, ka atomu veido citas mazas daļiņas, ko sauc par subatomiskām.
Atklājot elektronu, tomsons viņš formulēja modeli, kas pazīstams kā masu pudiņš, kurā atomu aprakstīja kā pozitīvu sfēru, kuras virsmā bija iestrādāti negatīvi lādēti elektroni.
Veicot eksperimentus, fiziķis Rezerforda atklāja, ka atomam ir tukšumi un elektroni ap ārkārtīgi mazu, pozitīvu kodolu. Tādējādi Rezerfords ierosināja kodola modeli, kas reprezentētu atomu.
Bohr uzlaboja Rezerforda piedāvāto modeli, konstatējot, ka elektroni ap kodolu rotē nevis nejauši, bet gan noteiktās orbītās. Šis modelis kļuva pazīstams kā planetārijs.
Lasiet arī par:
- Atomu modeļi
- Thomson Atomic Model
- Bora atomu modelis
- Rezerfordas atomu modelis
- Atomu modeļu evolūcija