Vielas ir materiāli, kuriem ir visas īpašības, kas ir precīzi noteiktas, noteiktas un praktiski nemainīgas.
Skatiet trīs piemērus:
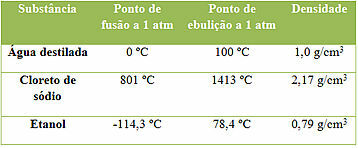
Trīs vielu un to īpašību piemēri
Ņemiet vērā, ka šīs ir trīs vielas un to īpašības ir nemainīgas, mērot vienā temperatūras un spiediena apstākļos. Bet katrai no tām ir atšķirīgas īpašību vērtības, jo nevienai divām vielām nav visu tieši tādu pašu īpašību. Tas ir svarīgi, jo tos var izmantot vielas identificēšanai.
Atomi ir mazākās matērijas sastāvdaļas, un tie var palikt izolēti, kā tas notiek, piemēram, hēlija gāzes gadījumā, ko veido hēlija (He) atomi; bet tie var arī saistīties dažādos veidos, veidojot molekulas (to molekulu gadījumā, kuras saistās kovalenti, daloties pāriem elektroni) vai jonu kopas (kas savienojas ar jonu savienojumu, kurā viens galīgi ziedo elektronus otram un veidojas joni, kas veido piesaistīt).
Tādējādi vielas var veidot atomi, molekulas vai jonu kopas. Ūdeni un etanolu veido molekulas, kas attiecīgi ir H2O un C2H5OH, bet nātrija hlorīdu veido jonu aglomerāti, kuru vienotā formula ir NaCa.

Ūdens un sāls ir vielu piemēri
Šie piemēri parāda, ka vielas var klasificēt pēc to veidojošo atomu grupas. Ja atomiem, kas savienojas, veidojot vielu, ir viens un tas pats ķīmiskais elements, tad mums ir vienkārša viela. Daži piemēri ir: skābekļa gāze (O2), ūdeņraža gāze (H2), dzelzs (Fe), hēlija gāze (He), alumīnijs (A?) utt.
No otras puses, ja vielas veido divu vai vairāku dažādu elementu, piemēram, ūdens, etanola un nātrija hlorīda, atomi, tie tiks klasificēti kā salikta viela.
Dabā nav ļoti bieži atrast vielas izolētā, tīrā veidā. Parasti tās ir sajauktas ar citām vielām. Piemēram, minerālūdens, kuru mēs dzeram, satur daudzas izšķīdušas vielas, ne tikai H molekulas.2O; tāpēc viņa ir Sajauc, nevis viela.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-substancia.htm

