Halogenīds ir organisks savienojums, kurā ir vismaz viens halogēna atoms. - tas ir, ķīmiskie elementi no periodiskās tabulas 17. vai VII saimes (F, Cl, Br, I vai vispārīgi: X) piesaistīts grupai, kas iegūta no ogļūdeņraža.
RX (kur X = F, Cl, Br vai I)
Daži halogenīdi ir parādīti zemāk:

Jods ir visreaktīvākais no visiem un fluors ir vismazāk, jo saistīšanās enerģija starp halogēnu un oglekli palielinās no joda virziena uz fluoru.
Vēl viens punkts ir tāds, ka reaktivitāte šajā ziņā arī palielinās:

Tādējādi šī reaktivitāte terciārajos oglekļa halogenīdos rodas vieglāk, pateicoties raksturīgumam, ko iegūst ar organisko halogenīdu saistītā ogleklis:

Tādējādi aizstājējgrupu, piemēram, OH, kas veidos spirtu, spēcīgāk piesaista terciārais ogleklis, kuram ir pozitīvs raksturs (1+), un aizstāšana ir vieglāka.
Halogenīdi var iziet reakcijas, kas ļauj mums iegūt praktiski visas citas organiskās funkcijas (cita starpā spirtu, ēteri, alkīnu, cianīdu vai nitrilu, amīnu). Tomēr praksē tas nav iespējams, jo halogenīdi ir ļoti dārgi savienojumi.
Lai iegūtu spirtu, piemēram, halogenīds tiek reaģēts ar spēcīgu bāzi, piemēram, nātrija hidroksīdu, ūdens vidē. Apskatīsim zemāk redzamo piemēru, kurā no etilhlorīda (hloretāna) sārmainas hidrolīzes tiks izveidots etanols:
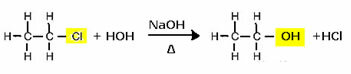
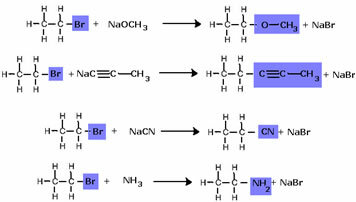
Ņemiet vērā, ka halogenīdu grupa tika aizstāta ar OH, alkohola funkcionālo grupu. Tādu pašu shēmu ievēro arī citu grupu veidošanā, diferencējot tikai reaģentu:
Autore Jennifer Fogaça
Beidzis ķīmiju
Brazīlijas skolu komanda
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/reacoes-substituicao-haletos-organicos.htm

