Kušanas un viršanas temperatūra norāda temperatūru, kurā viela mainās stāvoklī noteiktā spiedienā.
Kušanas temperatūras gadījumā viela pāriet no cietas uz šķidru stāvokli. Viršanas temperatūra attiecas uz pāreju no šķidruma uz gāzveida stāvokli.
Piemēram, ledus sāk pārvērsties ūdenī šķidrā veidā, kad tā temperatūra ir vienāda ar 0 ° C. Tādējādi ūdens kušanas temperatūra ir 0 ° C (zem 1 atmosfēras spiediena).
Lai pārietu no šķidruma uz tvaiku, ūdenim jāsasniedz 100 ° C temperatūra. Tādējādi ūdens viršanas temperatūra ir 100 ° C (zem 1 atmosfēras spiediena).

Kodolsintēzes punkts
Kad viela cietā stāvoklī saņem karstums, palielinās tā molekulu uzbudinājuma pakāpe. Līdz ar to arī tā temperatūra paaugstinās.
Sasniedzot noteiktu temperatūru (kušanas temperatūru), molekulu maisījums ir tāds, ka tas pārtrauc iekšējās saites starp atomiem un molekulām.
Šajā brīdī viela sāk mainīt savu stāvokli un nonāk šķidrā stāvoklī, ja tā turpina saņemt siltumu.
Laikā Kodolsintēze tā temperatūra paliek nemainīga, jo saņemto siltumu izmanto tikai stāvokļa maiņai.

Tiek saukts fāzes maiņai nepieciešamais siltums uz masas vienību latentais karstums kodolsintēzes (Lf) un ir vielai raksturīga iezīme.
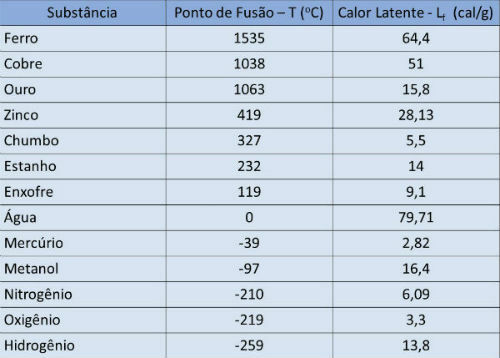
Kušanas temperatūra un latentā siltuma galds
Zemāk esošajā tabulā mēs norādām kušanas temperatūru un dažu vielu latento siltumu līdz atmosfēras spiediens.
Vārīšanās punkts
vārīšanās to raksturo ātra pāreja no šķidruma gāzveida stāvoklī, šķidruma iekšpusē veidojoties tvaikiem (burbuļiem).
Tāpat kā kodolsintēzes gadījumā ir temperatūra (viršanas temperatūra), kurā dotā viela pāriet no šķidruma uz gāzveida stāvokli.
Lai tas notiktu, vielai jāsaņem siltums. Visas fāzes maiņas laikā temperatūra paliek nemainīga.
latentais siltums iztvaicēšana (Lv) ir siltuma daudzums uz masas vienību, kas vajadzīgs, lai viela mainītu fāzi.
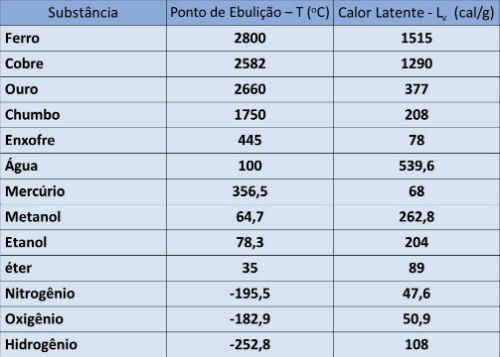
Viršanas punkts un latentā siltuma galds
Zemāk esošajā tabulā mēs norādām viršanas temperatūru un dažu vielu latento tvaicēšanas siltumu atmosfēras spiedienā.
Spiediena traucējumi
Kušanas un viršanas temperatūras temperatūra ir atkarīga no vielas spiediena.
Parasti vielu daudzums palielinās, kad tās tiek sapludinātas. Šis fakts nozīmē, ka jo augstāks spiediens, jo augstāka temperatūra vielai var mainīt fāzi.
Izņēmums notiek ar dažām vielām, ieskaitot ūdeni, kas, izkausējot, samazina tā apjomu. Šajā gadījumā augstāks spiediens pazeminās kušanas temperatūru.

Spiediena pazemināšanās dēļ noteiktas vielas viršanas temperatūra ir zemāka, tas nozīmē, ka viela vārīsies zemākā temperatūrā.
Piemēram, vietās virs jūras līmeņa ūdens vārās temperatūrā, kas zemāka par 100 ° C. Rezultātā šajās vietās gatavošana prasa daudz ilgāku laiku nekā vietās jūras līmenī.
Lasiet arī:
- Fiziskā stāvokļa izmaiņas
- Termometriskie svari
- Termometriskie svari - vingrinājumi
- Ūdens fizikālie stāvokļi
- Fāžu diagramma
- Sacietēšana
- Kondensāts
- Koligatīvās īpašības
- Periodiskās īpašības
- Iztvaicēšana
- Vingrinājumi periodiskajā tabulā



