* Arrhenius teorija:
Pamatojoties uz viņa eksperimentiem ar elektrovadītspēju ūdens vidē, ķīmisko, fizikālo un matemātisko Zviedru Svante Augusts Arrheniuss (1859-1927) 1884. gadā ierosināja šādus jēdzienus, lai definētu skābes un bāzes:

Tātad, vispārīgi, mums ir:
H+ + H2O → H3O+
Piemēri:
HCl + H2O → H3O++ Cl-
HNO3+ H2O → H3O+ + NĒ3-
H2TIKAI4+ 2H2O → 2H3O+ + OS42-

Piemēri:
NaOH → Na + + OH-
Ca (OH)2 → Ca2+ + 2 OH-
* Brēnsteda-Lovija teorija:
Neatkarīgi - dānis Johanness Nikolajs Brēnsteds (1879–1947) un anglis Tomass Martins Lovijs (1874-1936), tajā pašā gadā ierosināja vēl vienu skābes bāzes teoriju, kas pazīstama kā Brēnstedas-Lovijas teorija, kurā teikts, ka Sekojošs:

Šajā gadījumā ūdeņraža jons tiek uzskatīts par protonu. Tas ir redzams šādā reakcijā, kad ciānūdeņražskābe ziedo ūdenim protonu, kas tādējādi darbojas kā bāze:
HCN + H2O → CN- + H3O+
Šī reakcija ir atgriezeniska ar hidronija jonu (H3O+) var ziedot protonu CN jonam-. Tādējādi hidronija jons (H3O+) darbojas kā skābe un CN- kā bāzi.
CN- + H3O+→ HCN + H2O
* Luisa teorija:
Šo teoriju izveidoja amerikāņu ķīmiķis Gilbert Newton Lewis (1875-1946), un tā saka:

Šī teorija ievieš jaunu jēdzienu, ir visaptverošāka, taču neatceļ Brēnsteda-Lovija teoriju. Katrai Lewis skābei ir Brönsted skābe, un tāpēc katra Lewis bāze ir Brönsted bāze. Tas ir tāpēc, ka protons saņem elektronus, tas nozīmē, ka Luisa skābe var pievienoties vientuļam elektronu pārim Luisa bāzē.
Lūisam skābes bāzes reakcija sastāv no stabilākas koordinētas kovalentās saites veidošanās. Tātad, kad Luisa bāze ziedo elektronu pāri Luisa bāzei, viņi abi veido a koordinēt kovalento saiti, kurā abi elektroni nāk no viena no atomiem, kā piemērā zemāk:
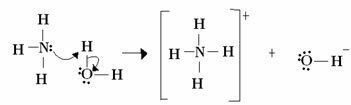
Šajā gadījumā amonjaks darbojas kā Lūisa un Brēnstedas bāze, jo tas ziedo savus divus elektronus protonam un tāpēc ir protona uztvērējs. Turklāt starp ūdeņradi (protonu) un amonjaku izveidojās kovalentā saite.
Ūdens ir Lūisa skābe un Brēnstedas skābe, tā kā tā ziedo protonu un saņem elektronus, pamaniet, kā skābeklim hidroksīdā, kas veidojas no ūdens, ir papildu elektronu pāris.

Autore Jennifer Fogaça
Beidzis ķīmiju
Brazīlijas skolu komanda.
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm
