Var gadīties, ka ir viena elementa skābes, un šim elementam ir vienāds oksidācijas skaitlis (NOX), bet atšķirība ir hidratācijas pakāpēs.
Piemēram, zemāk mums ir trīs skābes, ko veido elements fosfors (P):
H3Putekļi4 H4P2O7 HPO3
Ņemiet vērā, ka visās trijās skābēs fosfora oksidācijas skaitlis ir +5; atšķirība ir hidratācijas pakāpē.
Pamatojoties uz to, šīs skābes nomenklatūrā tiek diferencētas, izmantojot prefiksus orto, piro un meta.
Visvairāk hidratētās skābes sauc par orto. Dotajā piemērā pirmais (H3Putekļi4) tiek saukts skābe ortofosfors, jo tas ir visvairāk hidratēts no trim. Orto prefikss ir iztērējams, tāpēc lielākoties šī skābe vienkārši tiks saukta fosforskābe.
Prefiksi piro un meta tiek izmantoti ar ortoskābi kā atskaites punktu:
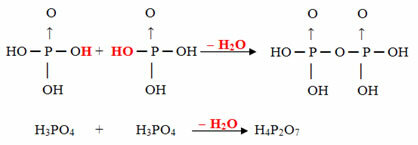
- Pīrss: 2 orto molekulas, atņemot 1 H molekulu2O
Piemērs: H4P2O7 tiek saukts skābe pirofosfors jo tas ir vienāds ar divām ortofosforskābes molekulām (H3Putekļi4) mīnus viena ūdens molekula.
2. H3Putekļi4 = H6P2O8
H6P2O8 - H2O = H4P2O7
Šis process ir a starpmolekulārā dehidratācija:
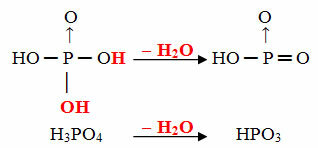
- Mērķis: 1 orto molekula mīnus 1 H molekula2O
Piemērs: HPO3 tiek saukts skābe mērķisfosfors jo tā ir vienāda ar ortofosforskābes molekulu (H3Putekļi4) mīnus viena ūdens molekula.
H3Putekļi4 - H2O = HPO3
Šis process ir a intramolekulāra dehidratācija:
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm
