Paulinga diagramma, kas pazīstama arī kā enerģijas diagramma, ir elektroniskās izplatīšanas attēlojums, izmantojot jaudas apakšlīmeņus.
Izmantojot šo shēmu, ķīmiķis Linuss Karls Polings (1901-1994) ieteica kaut ko vairāk par to, kas jau bija zināms attiecībā uz elektronu sadalījumu no ķīmisko elementu atomiem.
Lai uzlabotu garastāvokli, Polings ierosināja enerģijas apakšlīmeņus. Caur tiem būtu iespējams sakārtot elektronus no zemākā līdz augstākajam atoma enerģijas līmenim tā pamatstāvoklī.
Linus Pauling elektroniskā izplatīšana
Saskaņā ar Paulinga piedāvāto modeli elektrosfēra ir sadalīta 7 elektroniskie slāņi (K, L, M, N, O, P un Q) ap atoma kodolu, no kuriem katrs pieļauj maksimālo elektronu skaitu, kas ir attiecīgi 2, 8, 18, 32, 32,18 un 8.
Plkst elektronikas izplatīšana enerģijas apakšlīmeņi, vispirms parādot zemākās enerģijas elektronu, līdz tiek sasniegts augstākās enerģijas elektrons.
| Elektroniskie slāņi | Maksimālais elektronu skaits | Enerģijas apakšlīmeņi | ||||
|---|---|---|---|---|---|---|
| 1 | K | 2 un- | 1.s2 | |||
| 2 | L | 8 un- | 2s2 | 2. lpp6 | ||
| 3 | M | 18 un- | 3s2 | 3p6 | 3d10 | |
| 4 | N | 32 un- | 4s2 | 4p6 | 4.d10 | 4.f14 |
| 5 | O | 32 un- | 5s2 | 5. lpp6 | 5.d10 | 5.f14 |
| 6 | P | 18 un- | 6s2 | 6.lpp6 | 6.d10 | |
| 7 | J | 8 un- | 7s2 | 7p6 |
K slānim ir tikai viens (-i) apakšlīmenis, L-slānim ir divi apakšlīmeni (s un p), m-slānim ir trīs apakšlīmeni (s, p un d) utt.
S apakšlīmeņi pieļauj līdz 2 elektroniem, bet p apakšlīmeņi - līdz 6 elektroniem. Tālāk d apakšlīmenis ļauj sasniegt līdz pat 10 elektroniem, savukārt f apakšlīmeņi - līdz 14 elektroniem.
Ņemiet vērā, ka elektronu summa, kas izturējās katrā apakšlīmenī uz katru elektronu apvalku, rada maksimālo elektronu skaitu katrā no 7 apvalkiem.
K: s2 = 2
L un Q: s2 + lpp6 = 8
M un P: s2 + lpp6 + d10 = 18
N un O: y2 + lpp6 + d10 + f14= 32
Toreiz Paulings atklāja pieaugošā enerģijas kārtība:
1.s2 2s2 2. lpp6 3s2 3p6 4s2 3d10 4p6 5s2 4.d10 5. lpp6 6s2 4.f14 5.d10 6.lpp6 7s2 5.f14 6.d10 7p6
Turpmāk diagonālās bultiņas parādās diagrammā, lai elektroniski sadalītu elementus:
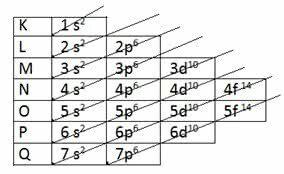 Paulinga diagramma
Paulinga diagramma
Elektroniskā fosfora izplatīšanas piemērs 15P:
1.s2 2s2 2. lpp6 3s2 3p3
patīk līdz 3 s2 mums jau bija kopumā 12 elektroni (2 + 2 + 6 + 2), mums vajag tikai vēl 3 elektronus no 3p apakšlīmeņa6.
Tādējādi mēs varam iegūt nepieciešamo elektronu daudzumu, ja vien tas nav lielāks par 6, kas ir maksimālais skaitlis, kāds 3p apakšlīmenī6 uzvedas.
Lasīt arī Valensijas slānis un Kvantu numuri.
Atrisināti uzdevumi par elektronisko izplatīšanu
jautājums 1
(Unirio) “Brazīlijā zobu implanti ir drošāki un jau tagad atbilst starptautiskajiem kvalitātes standartiem. Lielais kvalitātes lēciens notika titāna skrūvju un tapu izgatavošanas procesā, kas veido protēzes. Izgatavotas no titāna sakausējumiem, šīs protēzes tiek izmantotas zobu vainagu, ortodontisko ierīču un protēžu nostiprināšanai žokļa un žokļa kaulos. ” (Jornal do Brasil, 1996. gada oktobris.)
Ņemot vērā, ka titāna atomu skaits ir 22, tā elektroniskā konfigurācija būs:
a) 1s2 2s2 2. lpp6 3s2 3p3
b) 1s2 2s2 2. lpp6 3s2 3p5
c) 1s2 2s2 2. lpp6 3s2 3p6 4s2
d) 1s2 2s2 2. lpp6 3s2 3p6 4s2 3d2
e) 1s2 2s2 2. lpp6 3s2 3p6 4s2 3d10 4p6
Pareiza alternatīva: d) 1s2 2s2 2. lpp6 3s2 3p6 4s2 3d2.
Linusa Paulinga diagramma elektronu sadalījumam titānā ir:
2. jautājums
(ACAFE) Ņemot vērā jebkuru vispārēju M elementu, kam ir 1s elektroniskā konfigurācija2 2s2 2. lpp6 3s2 3p6 4s2 3d5, var teikt, ka:
Es tā atomu skaits ir 25;
II. pēdējā apvalkā ir 7 elektroni;
III. ir 5 nepāra elektroni;
IV. pieder 7A ģimenei.
Apgalvojumi ir pareizi:
a) tikai I, II un III
b) tikai I un III
c) tikai II un IV
d) tikai es un IV
e) tikai II, III un IV
Pareiza alternatīva: b) tikai I un III.
Es PAREIZI Saskaitot elektronu skaitu elektroniskajā sadalījumā, mēs redzam, ka tika izmantoti 25. Tādējādi atomu skaitlis ir 25 un tas atbilst mangāna ķīmiskajam elementam.
II. Nepareizi. Pēdējā slānī, tas ir, visattālākajā slānī ir 2 elektroni, kas ir 4s2.
III. PAREIZI Nepāra elektroni atrodas d apakšlīmenī, kas satur līdz 10 elektroniem, bet mangāna elektroniskajā izplatīšanā apakšlīmenim ir piešķirti tikai 5 elektroni.
IV. Nepareizi. Mangāns atrodas 7B ģimenē un 4. periodā.
3. jautājums
(UFSC) Elektronu skaits katrā stroncija atoma apakšlīmenī (38Sr) enerģijas pieaugošā secībā ir:
a) 1s2 2s2 2. lpp6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2. lpp6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2. lpp6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2. lpp6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2. lpp6 3p6 3s2 4s2 4p6 3d10 5s2
Pareiza alternatīva: a) 1s2 2s2 2. lpp6 3s2 3p6 4s2 3d10 4p6 5s2.
Linusa Paulinga diagramma stroncija elektronu sadalījumam ir:
Pārbaudi savas zināšanas vēl vairāk! Atrisiniet arī:
- Vingrinājumi par elektronisko izplatīšanu
- Vingrinājumi periodiskajā tabulā