Kad mēs sakām vārdu “līdzsvars”, prātā nāk objekts, kas paliek bezgalīgi. Tomēr tas ir tikai viena veida līdzsvars, ko sauc “Statiskais līdzsvars”.
Ir arī “Dinamiskais līdzsvars”. Tajā, kā saka nosaukums, nav neviena brīža, kurā attiecīgais objekts vai parādība joprojām atrodas. Piemēram, lai jūs saprastu, skatiet zemāk redzamo ilustrāciju un ņemiet vērā, ka ūdens daudzums, kas iekrīt traukā, ir vienāds ar daudzumu, kas no tā izplūst, saglabājot nemainīgu ūdens līmeni. Tādā gadījumā mēs sakām, ka pastāv a dinamisks līdzsvars, līdzsvars kustībā.

Tas ir šāda veida līdzsvars, kas notiek atgriezeniskas reakcijas, tas ir, tajās reakcijās, kas notiek abos virzienos. Tajā pašā laikā, kad reaģentu molekulas tiek pārveidotas produktos, produktu molekulas reaģē savā starpā, veidojot reaģentus. Reakcijas atgriezeniskumu attēlo bultiņas abos virzienos:
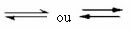
Kad tiešās reakcijas (produktu veidošanās) attīstības ātrums ir vienāds ar apgrieztā reakcija (reaģentu veidošanās) pastāvīgā temperatūrā nozīmē, ka reakcija ir sasniegusi līdzsvaru ķīmiskais.
Ja notiek reakcijas, kurās reaģentos un produktos ir tikai molekulas, mums ir molekulārais līdzsvars.Šis ir reakcijas, kas notiek starp ūdeņraža gāzi (H2) un joda gāzi (I2), ūdeņraža jodīda (HI) gāzes veidošanai:
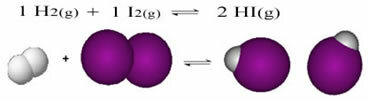
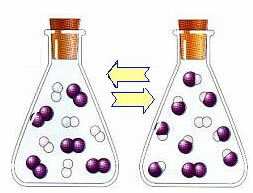
Reakcijas sākumā tiešās reakcijas attīstības ātrums bija lielāks, pēc tam, kad visa reaģentu koncentrācija bija maksimāla un produktu koncentrācija bija nulle. Tātad arī reversās reakcijas attīstības ātrums bija nulle.
Tomēr laika gaitā ūdeņraža un joda gāzes reaģē, radot produktu. Tādā veidā reaģentu koncentrācija sāk samazināties un samazinās arī to attīstības ātrums.
Palielinoties produktu koncentrācijai un reaģentu koncentrācijai samazinoties, sāk palielināties apgrieztās reakcijas attīstības ātrums. Ja temperatūra tiks turēta nemainīga, pienāks brīdis, kad abi attīstības ātrumi paliks nemainīgi, tādējādi parādot, ka reakcija ir sasniegusi ķīmisko molekulāro līdzsvaru.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm

