Nosauktie elementi sārmu zemes metāli ir tie, kas pieder pie periodiskās tabulas 2. vai IIA saimes. Šādu grupu veido šādi ķīmiskie elementi: Esiet (berilijs), Mg (magnijs), Ca (kalcijs), Sr (stroncija), Ba (bārijs) un radijs (Ra).

Viņiem valences apvalkā ir divi elektroni, un to vispārīgo sadalījumu attēlo ns2, kur Nē apzīmē pēdējā līmeņa numuru. Šīs īpašības dēļ viņiem ir tendence zaudēt šos divus elektronus, radot 2+ lādēšanas katjonus.
Termins “zeme” attiecas uz “eksistenci uz zemes”, jo tieši šie elementi ir sastopami galvenokārt minerālos. Piemēram, kalcijs kalcija fosfāta savienojuma (Ca3(Putekļi4)2), atrodas zemes garozā un kalpo kā izejviela fosfora ražošanai. Tas atrodas arī dzīvnieku kaulos, tik daudz, ka, tos kalcinējot, iegūst tā saucamo “kaulu miltus”, kas satur kalcija fosfātu.
Starp sārmzemju metāliem visvairāk izceļas Kalcijs tas ir Magnijs.
- Kalcijs
Kalcija jons (Ca2+) ir apmēram 90% mūsu kaulu un zobu; un dzīvniekiem tas atrodas arī to čaumalās. Tās funkcija ir stiprināt kaulu struktūru un kalpot kā muskuļu relaksants. Kalcija trūkums organismā var izraisīt muskuļu krampjus, stingumkrampjus un osteoporozi. Tāpēc ir svarīgi to ēst ar pārtiku, kas bagāta ar kalciju, piemēram, pienu un tā atvasinājumus (sviestu, sieru utt.), Gaļu un dārzeņus.
No otras puses, pārāk daudz kalcija var izraisīt muskuļu relaksāciju, nierakmeņus un sāpes kaulos.
Papildus iepriekšminētajiem pārtikas produktiem kalcijs joprojām ir sastopams daudzās dabas daļās, īpaši minerālos, piemēram, kalcītā (CaCO3) vai kalcija karbonātu, kas ir kaļķakmens un marmora sastāvdaļa, un marmoru izmanto izlietņu, statuju, grīdu un kāpņu ražošanā. Kalcija karbonāts ir arī stalaktītu un stalagmitu veidotājs alās. Kalcijs ir arī dabiskajā ģipsī (CaSO4. 2 stundas2O), ko sauc par ģipsi. Šo sāli var dehidrēt, izraisot CaSO4 bezūdens, kas ir skolas krīts.
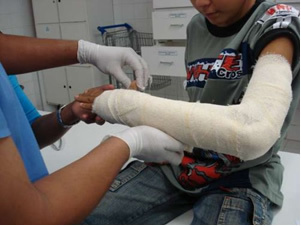
Rūpniecībā tiek ražots neapstrādāts kaļķis (CaO), dzēsts kaļķis, saukts arī par hidratētu kaļķi vai dzēsts kaļķis, kas faktiski ir kalcija hidroksīds (Ca (OH)2), ko izmanto balināšanas krāsās un javas sagatavošanā. Viegla ģipša karsēšana ļauj iegūt būvniecībā izmantoto hemihidrēto kalcija sulfātu, kas ir ģipsis. pilsoniskā sabiedrība, veidojot veidnes zobārstniecībā un medicīnā, lai aizsargātu kaulu lūzumus, piemēram, zemāk redzamo roku.
- Magnijs
jonu magnijs tai ir arī liela bioloģiskā nozīme, jo tā atrodas 70% mūsu kaulu, veicinot fermentu darbību, muskuļus un kustību koordināciju. Tā trūkums organismā var izraisīt dezorientāciju, hipertensiju, trīci un vāju pulsu. Tāpēc mums vajadzētu ēst šādus pārtikas produktus, kas satur šo elementu: riekstus, graudus un zaļos dārzeņus. Arī pārmērīgs magnija daudzums organismā var izraisīt miegainību.
Magnijs pastāv arī jūras ūdenī un minerālos. To lieto metāla sakausējumos, piemēram, ziedojošos metālos (kas oksidējas tērauda vietā, novēršot tā koroziju), “magnija” riteņos un uguņošanas ierīcēs (piedāvājot sudraba un baltas krāsas). Ļoti svarīgs magnija savienojums ir magnija hidroksīds (Mg (OH)2), kas, izkliedējot ūdenī aptuveni 7% koncentrācijā, rada zināmu suspensiju tautā kā magnēzija piens, kas kalpo kā antacīds līdzeklis, apkaro kuņģa skābumu (grēmas) un kā caurejas līdzeklis.

Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm

