Neitralizējoša reakcija notiek, kad skābe reaģē ar bāzi, veidojot ūdeni un sāli. Skābe nodrošina H jonus+ un bāze nodrošina OH jonus- ūdens veidošanai (H2O):
1 stunda+(šeit) + 1 OH-(šeit) → H2O(ℓ)
Šāda veida reakciju sauc par “neitralizāciju”, jo barotnes pH ir neitralizēts; ūdens pH ir 7,0 (neitrāls).
Lai šīs reakcijas notiktu, ir nepieciešams atbrīvot noteiktu daudzumu siltuma, jo tikai daļa no enerģijas jonus izmanto, lai izveidotu saites, kuru rezultātā rodas ūdens molekulas, bet pārējā enerģija tiek izdalīta diezgan. Šī atbrīvotā enerģija tiek saukta Neitralizācijas entalpija (∆Hneitralizācija).

Tā kā tas izdala siltumu, tas atbilst eksotermiskām reakcijām, kurās entalpija (sistēmas globālā enerģija) vienmēr būs negatīva, mazāka par nulli.
Reakcijas gadījumā starp spēcīgām skābēm un stiprām bāzēm neitralizējošā entalpijas vērtība vienmēr būs vienāda ar - 13,8 kcal / mol vai - 57,7 kJ / mol. Tas notiek tāpēc, ka bāzes un stiprās skābes ir pilnībā disociētas šķīdumā un tāpēc vienīgās Reakcija, kas ir atbildīga par siltuma izpausmi, būs ūdens veidošanās, kā parādīts trīs tālāk sniegtajos piemēros:
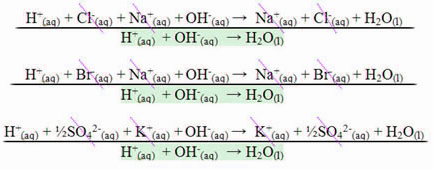
Neitralizācijas reakciju gadījumā, kurās iesaistītas vājas skābes vai bāzes, neitralizējošās entalpijas vērtība būs mazāka par –57,7 kJ / mol.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/entalpia-neutralizacao.htm
