Plkst molekulas tās ir struktūras, kurām ir noteikta molārā masa un salīdzinoši mazs un precīzs atomu skaits, kas savienoti kopā kovalenti, tas ir, daloties elektronos.
Skatiet trīs piemērus:
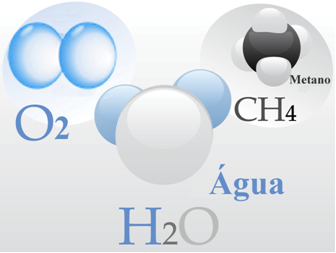
- Skābekļa gāze: katra tā molekula veidojas ar dubultu saiti, tas ir, dalot divus elektronu pārus starp diviem skābekļa atomiem (O2);
- Ūdens: to veido H molekulas2O. Tas nozīmē, ka katrai molekulai ir divi ūdeņraža atomi, kas dala elektronu pāri ar skābekļa atomu.
- Metāns: šo savienojumu veido CH molekulas4, kurā četri ūdeņraža atomi kovalenti saistās ar vienu oglekļa atomu.
Molekulārām vielām ir dažas raksturīgas īpašības, piemēram:
- Dažāda šķīdība ūdenī un citos šķīdinātājos;
- Viņi var sevi parādīt trīs fiziskajos stāvokļos;
- Parasti tie ir elektriski izolatori, gan cieti, gan šķidri.
Visas molekulas veido nemetāliski elementi, tas ir, tie ietver tikai ūdeņradi, nemetālus un pusmetālus. Bet šie elementi var veidot arī vielas, kas atrodas tikai cietā stāvoklī un kurām ir ļoti atšķirīgas īpašības nekā molekulām. tie ir makromolekulas.
Makromolekulas, kas pazīstamas arī kā kovalentās cietās vielas vai kovalentas tīkla cietvielas,tās ir struktūras ar ļoti lielu un neprecīzu molisko masu, turklāt tās veido liels un nenoteikts atomu daudzums, kas kovalenti savienojas, veidojot trīsdimensiju režģus. Makromolekulas veido kovalenti kristāli vai atomu kristāli.
Piemēram, oglekļa atomi var dažādos veidos dalīt elektronus un veidot daudz dažādu vienkāršu vielu. Šim īpašumam, kam vienam un tam pašam ķīmiskajam elementam ir jāveido divas vai vairākas dažādas vienkāršas vielas, tiek piešķirts nosaukums alotropija.
Divas oglekļa alotropās šķirnes, kas veido makromolekulas, ir Dimants un grafīts. Zemāk redzamajos attēlos jūs varat redzēt, ka dimanta gadījumā katrs oglekļa atoms saistās ar četriem citiem oglekļa atomiem un rada makromolekulu ar tetraedrisku struktūru.

Tikmēr grafīta struktūru veido sešstūra gredzeni, kas atrodas vienā plaknē. Oglekļa atomi veido vienu dubulto un divas atsevišķās saites.

Bet makromolekulas veido ne tikai viena veida elementi; tos var veidot arī no dažādu ķīmisko elementu atomiem.
Piemērs ir silīcija dioksīds (kvarcs), kura makromolekulās katru silīcija atomu ieskauj četri oglekļa atomi un katrs skābekļa atoms ir saistīts ar diviem silīcija atomiem.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/moleculas-macromoleculas.htm