Ogleklis ir ķīmiskais elements, kura atoma skaitlis (Z) ir vienāds ar 6, kas nozīmē, ka to veidojošo atomu kodolā ir seši protoni. Tās molārā masa ir 12,011 g / mol, un dabā ir atrodami trīs oglekļa izotopi, kas ir: o ogleklis-12, ogleklis-13 un ogleklis-14. C-12 kodolā ir seši protoni un seši neitroni, un tā ir visplašākā.
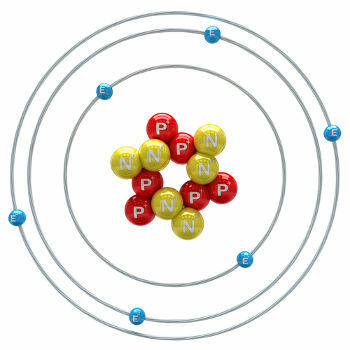
oglekļa atoms-12 ilustrācija
C-13 ir septiņi neitroni, un to ir vismazāk (no 1,01 līdz 1,14%). C-14 ir astoņi neitroni, un tas ir a radioaktīvs elements kas izstaro β daļiņas (elektronus), veidojoties Zemes stratosfērā, kad kosmisko staru neitroni bombardē slāpekli-14, kas atrodas šajos atmosfēras augšējos slāņos. To iekļauj visi augi un dzīvnieki, un, zinot, ka tā pussabrukšanas periods ir aptuveni 5730 gadi, to izmanto, lai noteiktu fosiliju vecumu no 100 līdz 40 000 gadiem. Sīkāka informācija par C-14 un datēšanas tehniku ir redzama tekstā. Kas ir ogleklis-14?
Ogleklis ir četrvērtīgs, tas ir, tā valences slānī (ārējā slānī) nepieciešami vēl četri protoni, lai pakļautos okteta likumam. Tāpēc tas parasti izveido četras kovalentās saites, dalot četrus elektronu pārus ar citiem elementiem, kā arī ar citiem oglekļiem. Šīs saites var būt vienas, dubultas vai trīskāršas, kā rezultātā var veidoties miljoniem dažādu savienojumu. Šī iemesla dēļ tika izveidota ķīmijas joma
Organiskā ķīmija, kurā tiek pētīti galvenie savienojumi, kas iegūti no oglekļa, izņemot dažus gadījumus, kas ir minerālu izcelsmes, piemēram, oglekļa dioksīds (CO2), O oglekļa monoksīds (CO), O kalcija karbonāts (CaCO3), nātrija hidrogēnkarbonāts vai nātrija bikarbonāts (NaHCO3), starp citiem. Šie savienojumi tiek pētīti Neorganiskā ķīmija.Ogleklis veic alotropiju, veidojot vienkāršas vielas, tas ir, vielas, kuras veido tikai saites starp oglekļa atomiem. Ir vismaz septiņi oglekļa alotropi, kas ir grafīts (alfa un beta), dimants, lonsdaleīts (sešstūrains dimants), haoīts, ogleklis (VI) un fullerēni. Patiesībā ir vairāki fullerēnu veidi, kas ir sintētiskas oglekļa alotropās formas. Viņiem ir daudzskaldņu struktūra ar oglekļa atomu katrā virsotnē, un piemērs ir Ç60 sauca buckminsterfullerene, un tā struktūra izskatās kā futbola bumba.
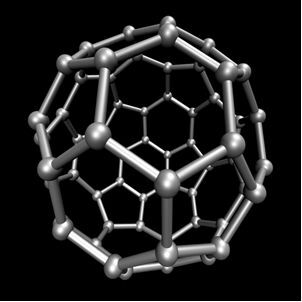
Ogleklis-60 (buckminsterfullerene)
Tomēr starp šiem oglekļa alotropiem ir tikai divi dabiski. grafītsTas ir no Dimants. Tie atšķiras tikai ar kristālu atomu izvietojumu telpā, kā parādīts zemāk redzamajā attēlā, un tas rada pilnīgi atšķirīgas fizikāli ķīmiskās īpašības. Lasīt tekstu oglekļa alotropija lai iegūtu vairāk informācijas.

Abas dabiskās oglekļa alotropās formas ir grafīts un dimants.
Cita sintētiskā oglekļa sintētiskā forma ir nanocaurules (attēls zemāk), kuriem ir plašs bioloģiskais pielietojums, ieskaitot medicīnisko diagnostiku un ārstēšanu.

Mikroskopiskas oglekļa nanocaurules ilustrācija
Tādējādi ogleklis ir klāt visā mums apkārt un mūsos, jo viņš komponē dabiskie organiskie savienojumi - piemēram, fosilais kurināmais, kas ietver naftu, ogles un dabasgāzi, un citas degvielas, piemēram, etanols un biodegviela - lauksaimniecības produkti, cita starpā. forma arī sintētiskie organiskie savienojumi, piemēram, sintētiskās šķiedras, kas veido audumus, zāles, polimēri, kas veido plastmasu un gumijas, insekticīdi, krāsvielas un daudz kas cits. Dzīvniekos un dārzeņos mūsos ogleklis veido ļoti svarīgus savienojumus, piemēram, ogļhidrātus, piemēram, cukuru, glikozi un celulozi; olbaltumvielas, kas veido, piemēram, DNS, un kopā ar lipīdiem veido sarkano asins šūnu un balto asins šūnu membrānas.
Tas viss parāda oglekļa nozīmi dzīves uzturēšanā. Bet tas ir saistīts arī ar negatīviem aspektiem, piemēram, siltumnīcas efekts un no tā izrietošais globālā sasilšana, tas ir tāpēc, ka galvenais šo problēmu ļaundaris ir tā oglekļa dioksīda savienojums (CO2). Galvenokārt fosilā kurināmā lielā sadedzināšanas dēļ, kas atbrīvo šo gāzi, CO koncentrācija2 atmosfērā ir palielinājies. Tā kā siltumnīcefekta gāze rada minētās problēmas. No otras puses, oglekļa dioksīds atrodas arī vitāli svarīgās reakcijās, piemēram, fotosintēzē un elpošanā.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-carbono.htm

