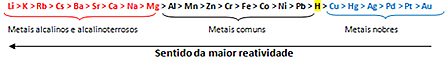
jonizācijas konstante dod Ūdens(Kw), O ūdeņraža potenciāls(pH) tas ir hidroksiljonu potenciāls (pOH) viņi ir pasākumi svarīgi aprēķiniem, kas saistīti ar ķīmiskais līdzsvars skābos un bāziskos šķīdumos, kā arī nosakot H jonu koncentrāciju+ un ak- no attiecīgajiem risinājumiem.
Kas ir Kw?
Ūdens vai Kw jonu produkts (tas wnozīmē ūdens - ūdens, angļu valodā) ir konstante, ko izmanto, lai attēlotu līdzsvars, ko rada ūdens pašjonizācija. Pat ļoti mazā ātrumā ūdens jonizē, veidojot H jonus+ un ak-, saskaņā ar šādu ķīmisko vienādojumu:
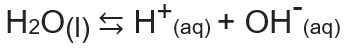
Analizējot vienādojumu, mēs saprotam, ka tad, kad jonizācija no tīra ūdens molekulas rodas H jons.+ un OH jonu-, tas ir, šo jonu koncentrācija vienmēr būs vienāda. Pat tad, ja notiek temperatūras paaugstināšanās, kas izraisa jonizācijas ātruma palielināšanos, koncentrācijas paliek nemainīgas.
Lasiet arī:Jonizācijas enerģija
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Pamatojoties uz eksperimentālajiem mērījumiem, tika aprēķināta H jonu koncentrācija
+ un ak- (kas rodas ūdens pašjonizācijas rezultātā) 25 ° C temperatūrā un 1. 10-7 mol / L. Tas ir, no 1 miljarda ūdens molekulu, tikai divi tiek pakļauti jonizācijai. Tas parāda, ka tīram ūdenim ir zema jonizācijas pakāpe, un tas izskaidro ļoti zemo līmeni Elektriskā vadītspēja tīra ūdens.Ņemot vērā iepriekš parādīto, mēs varam uzrakstīt izteiksme ūdens bilances konstante:

Izmantojot H jonu koncentrācijas vērtības+ un ak- pie 25 ° C mēs varam aprēķināt K vērtībuw:
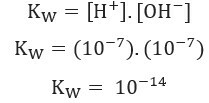
Kā minēts iepriekš, šī vērtība Kw mainās, paaugstinoties temperatūrai, kā parādīts zemāk esošajā tabulā:
T (° C) |
Kw |
10 |
0,29. 10-14 |
20 |
0,68. 10-14 |
25 |
1,00. 10-14 |
30 |
1,47. 10-14 |
40 |
2,92. 10-14 |
60 |
9,40. 10-14 |
Lai uzzinātu vairāk par šo tēmu, izlasiet mūsu tekstu: Joniskā ūdens produkts.
Kas ir pH un pOH?

saīsinājums pH nozīmē ūdeņraža potenciāls un to izveidoja Dānijas bioķīmiķis Sorens Sorensens, 1909. gadā, lai atvieglotu darbu ar ūdeņraža jonu koncentrācija [H+], kuras parasti izsaka decimāldaļās. Lai uzzinātu vairāk par šo tēmu, izlasiet mūsu tekstu: Kas ir pH?
Šāda veida apzīmējumi norāda H jonu saturu+ klāt šķīdumā un to nosaka matemātiskā izteiksme:
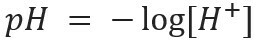
Līdzīgi mēs varam definēt pOH vai hidroksiljonu potenciāls, kas mums norāda OH jonu saturs- klāt šķīdumā. Tās matemātiskā izteiksme ir:
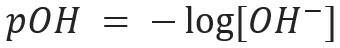
Ūdens šķīdumā vienmēr būs H joni+ un ak- (ūdens jonizētās jonizācijas dēļ), ko izmantos, lai raksturotu šķīdumu skābs vai pamata. Jo vairāk H jonu+ šķīdumā ir, jo skābāks tas būs. Līdz ar to OH jonu klātbūtne- risinājumā padarīs to pamata. Ja šo jonu daudzumā ir līdzsvars, šķīdums tiks klasificēts kā neitrāls.
pH skala
Tiek parādīta pH skala ar vērtībām, kas svārstās no 0 līdz 14 (vērtības mēra 25 ° C temperatūrā). Skatiet pH skalu zemāk esošajā attēlā:

Jo zemāks pHšķīduma,lielāks ir tā skābums, un jo tuvāk skalas beigām, tas ir, tuvāk 14, jo lielāks būs tā pamat raksturs. Piemēram, citronu sulas pH ir 2, savukārt balinātāju pH ir 12.
Kā aprēķināt pH un pOH
zinot jonu koncentrācija, mēs varam aprēķināt vērtības šķīdumu pH un pOH, un, zinot potenciālās vērtības, mēs aprēķinām jonu koncentrācija šķīdumos. Šim nolūkam tiek izmantoti šādi izteicieni:
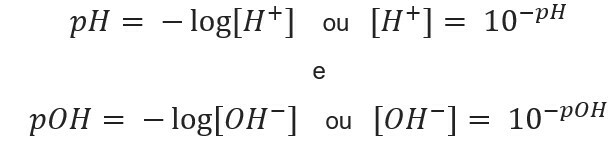
Pārejam pie piemēriem:
1. piemērs
Ja mēs vēlamies uzzināt šķīduma pH ar [H+] = 0,001 mol / L, vienkārši izmantojiet iepriekš sniegto formulu:
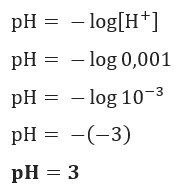
2. piemērs
Tagad, lai uzzinātu, kāda ir OH koncentrācija- šķīdumam ar pOH = 5, vienkārši aizvietojiet vērtību šajā formulā:

Ja ūdens jonu līdzsvaram izmantosim to pašu potenciālu skalu, mums būs:
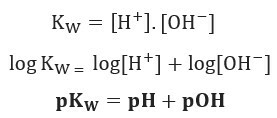
Kā norādīts, 25 ° C temperatūrā Kw = 10-14. Tādēļ:

Ar to mēs varam aprēķināt šķīduma pOH, pamatojoties uz tā pH. Ja mums ir šķīdums ar pH 3, tad tā pOH būs 11.
Uzziniet vairāk: Neitrāla, skāba un bāziska vide
Vingrinājumi atrisināti
1. jautājums (UEFS-BA) OH jonu koncentrācija–(šeit) noteiktā amonija hidroksīda šķīdumā 25 ° C temperatūrā ir vienāds ar 1,10–3 mol / L. Šī šķīduma pOH ir:
a) 0
b) 1
c) 3
d) 11
e) 13
Izšķirtspēja: C burts. Ja mums ir [OH–] = 10–3 mol / L, tātad jūsu pOH būs vienāds ar 3.
Skaties:
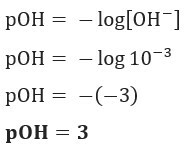
2. jautājums (UEA-AM) Apsveriet šādu informāciju, kas iegūta no minerālūdens marķējuma Porto Seguro pilsētā (BA):
nitrāts 1,45 mg / l
pH pie 25 ° C 4.51
Šis minerālūdens ir
a) skāba un satur [H+] –].
b) skāba un satur [H+]> [OH–].
c) neitrāls un tam ir [H+] = [OH–].
d) pamata un ir [H+]> [OH–].
e) pamata un ir [H+] –].
Izšķirtspēja: Burts B. Tā kā uz etiķetes norādītā minerālūdens pH ir mazāks par 7, mēs varam teikt, ka tas ir skābs šķīdums un tāpēc H jonu koncentrācija+ ir lielāks nekā OH-.
3. jautājums (UEA-AM) Viens veids, kā laboratorijā ātri ražot gāzveida ūdeņradi, ir pulverveida metāla cinka reakcija ar sālsskābi (HCl) koncentrācijā 1,0 mol / L:
Zn (s) + 2 HCl (aq) → ZnCl2 (aq) + H2 g)
Ņemot vērā, ka sālsskābe ir 100% jonizēta un ka šķīdums ir 25 ° C temperatūrā, ir pareizi apgalvot, ka tekstā minētā sālsskābes šķīduma pH ir
- 0
- 1
- 3
- 13
- 14
Izšķirtspēja:Vēstule a. Mēs varam aprēķināt šķīduma pH, izmantojot tekstā norādīto HCl koncentrāciju, jo, tā kā tas ir 100% jonizēts, [H+] būs vienāds, jo katrai jonizētajai HCl molekulai ir viens H jons+ tiks ģenerēts. Tādēļ:
Autors Viktors Ferreira
Ķīmijas skolotājs