“Ķīmiskā saite ”bija termins, kuru 1920. gadā Gilberts Ņūtons Lūiss pirmo reizi izmantoja rakstā, lai izskaidrotu iemeslu ka atomi turas kopā, veidojot vielas, un arī to, kāpēc tie turas kopā vairāk nekā tūkstošiem gadus vecs.
Lielākās daļas līdz šim periodiskajā tabulā zināmo un uzskaitīto ķīmisko elementu atomi dabā neparādās izolētā formā. Lielākā daļa no mūsu ikdienas dzīvē esošajiem materiāliem ir vielas, kas var būt vienkāršas (sastāv no atomiem tikai viena veida ķīmisko elementu) vai kompozītiem (ir divu vai vairāku ķīmisko elementu atomi) daudz dažādu).
Tas ir tāpēc, ka atomiem ir iespēja veidot ķīmiskas saites ar citiem atomiem, kas var būt viens un tas pats elements vai dažādi elementi. Šīs saites ir tik spēcīgas, ka bez ārējas ietekmes vairumā gadījumu atomi paliks savienoti tādi, kādi tie ir.
Prāta karte: ķīmiskās saites

* Lai lejupielādētu domu karti PDF formātā, Noklikšķiniet šeit!
Piemēram, dabā nav ierasts atrast brīvu skābekļa atomu; tomēr mēs atrodam vairākas vielas, kurās tas šķiet piesaistīts citiem atomiem. Vienkāršas vielas piemērs ir skābekļa gāze, kurā katru molekulu veido divi saistīti skābekļa atomi (O
2); savukārt saliktas vielas piemērs ir ūdens, kur katrai molekulai ir divi ūdeņraža atomi, kas saistīti ar skābekļa atomu (H2O).Vienīgie elementi, kas dabā ir stabili izolēti, ir cēlās gāzes, tas ir, periodiskās tabulas 18. saimes elementi (He, Ne, Ar, Kr, Xe un Rn). Visiem šiem elementiem ir kopīgs fakts, ka pēdējā elektronu apvalkā (valences slānī) tiem ir astoņi elektroni, izņemot hēliju (He), kurai ir tikai viens elektronu apvalks (K slānis), un tāpēc tajā ir divi elektroni, kas ir maksimālais iespējamais elektronu skaits tajā slānis.
Tādējādi Gilberts N. Lūiss un arī zinātnieks Water Kossel nonāca pie tā pārējo elementu atomi saistās ar astoņiem elektroniem (vai diviem, ja jums ir tikai K apvalks) un tādējādi stabilizējas. Tad tā tika izveidota elektroniskā valences teorija, kas norāda, cik ķīmisko saišu veido elementa atoms, pamatojoties uz izskaidroto ideju.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Tāpēc atomi veido ķīmiskas saites, cenšoties zaudēt, iegūt vai dalīt valences čaulas elektronus, līdz tie sasniedz nākamās cēlgāzes konfigurāciju.Arī šo teoriju sāka saukt okteta likums.
Piemēram, skābeklis ir divvērtīgs, jo tā valences apvalkā ir seši elektroni. Tāpēc tai ir jāsaņem vēl divi elektroni, lai būtu cēlgāzes neona (Ne) konfigurācija, tas ir, ar astoņiem elektroniem valences apvalkā, kas šajā gadījumā ir L apvalks. Minētās skābekļa gāzes un ūdens gadījumā mums ir šādas iespējas:
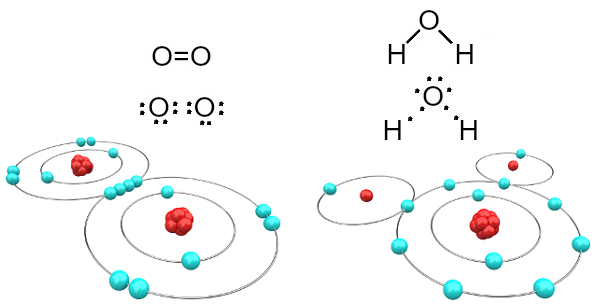
Skābekļa un ūdens molekulas, ko veido kovalentās saites
Jāņem vērā, ka pirmajā gadījumā (skābekļa gāze - O2), katram skābekļa atomam ir divi elektroni, kuru abiem valences apvalkā ir astoņi elektroni. Tas nozīmē, ka a dubultā saite (divas saites vienlaikus starp diviem atomiem).
Ūdens gadījumā katram no diviem ūdeņraža atomiem ir kopīgs elektrons ar centrālo skābekļa atomu un visi ir stabili (skābeklim valences apvalkā ir astoņi elektroni, un katram ūdeņradim ir divi elektroni). Šeit tiek veikti arī divi vienkārši savienojumi.
Šāda veida ķīmiskā saite, kurā visiem atomiem ir jāsaņem elektroni (ūdeņradis, nemetāli un pusmetāli) un kurā elektroni tiek dalīti pa pāriem, tiek saukts kovalentā saite.
Bet ir vēl divi ķīmisko saišu veidi:
(1) jonu saite → notiek elektronu galīgā pārnešana no viena atoma uz otru. Šis savienojuma veids notiek starp metāla atomiem (kuriem ir tendence zaudēt elektronus, lai paliktu stabils) un ūdeņraža atomi, nemetāli un pusmetāli (kuriem ir tendence iegūt elektronus, lai tie paliktu stabils).
Piemērs ir nātrija hlorīds (NaCl - galda sāls), kur nātrijs ir metāls, kuram ir tendence zaudēt elektronu, bet hlors ir nemetāls, kuram ir tendence iegūt elektronu. Tādējādi nātrijs ziedo(sarkanā bultiņa)elektrons hloram, veidojot sāli, ļoti stabila viela. Tā kā viņi absolvē (melna bulta) joni, kas ir ķīmiskas sugas ar pretēju lādiņu (+ un -), viens jons piesaista otru tuvumā, un tiek veidotas jonu kopas ar milzīgu jonu skaitu, tāpat kā galda sāls kristāli.

Nātrija hlorīda veidošanās jonu savienojuma ceļā
(2) Metāla savienojums → Tā ir teorija, ka metālus (piemēram, alumīniju, zeltu, sudrabu, varu uc) veido neitronu atomu kopa un katjonus, kurus tur kopā sava veida brīvo elektronu "mākonis" (elektroni, kas tika zaudēti, veidojot katjonus) citēts). Šis elektronu mākonis (vai jūra) darbotos kā metāla saite, kas saturētu atomus kopā.
Lai iegūtu sīkāku informāciju par šiem ķīmisko saišu veidiem, kā arī okteta likumu, lasiet saistītos rakstus zemāk.
Prāta karte, autors: M. Viktors Rikardo Ferrreira
Ķīmijas skolotājs
Autore Jennifer Fogaça
Beidzis ķīmiju
Ķīmija

Jonu saite, sakari starp jonu savienojumiem, jonu aglomerātiem, nātrija hlorīdu, galda sāli, jonu vielu, elektrostatiskās pievilkšanās spēki, hlorīda anjoni, nātrija katijoni, polārie šķīdinātāji, pozitīvie joni, katjoni, negatīvie joni, anjoni.

