O amonija nitrāts ir cieta viela ar molekulāro formulu NH4PIE3 balts izskats (tīrs). izveidota pēc joni NH4+ (amonijs) un NO3- (nitrāts), nav viegli uzliesmojošs, bet ir ļoti oksidējošs un reaģējošs. Tā sadalīšanās reakcija kā produkts rada lielu daudzumu gāzu, kas padara neatbilstošu šī produkta uzglabāšanu par nopietnu problēmu, jo var notikt sprādzieni. Un arī plaši izmanto lauksaimniecībā kā mēslojums.
Lasiet arī: Dabiskas vielas - molekulas cēlušās no dabas
Kas ir amonija nitrāts?

Amonija nitrāts tas ir sāls sastāv no NH joniem4+ (amonijs) un NO3- (nitrāts). Tas ir ciets savienojums, kad tīrs, tā ir baltā krāsā. To plaši izmanto kā lauksaimniecības mēslojumu, bet to var izmantot arī sprāgstvielu ražošanā, kā tā ir ļoti oksidējoša viela, pēc tam oksidējot. Amonija nitrāta pārbēgamā reakcija rada lielu gāzes, izraisot sprādzienbīstama ietekme.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Amonija nitrāta raksturojums
Molārā masa: 80,04336 g / mol.
Sāls, kas sastāv no joniem: amonijs (NH4+) un nitrātu (NO3-).
Izskats: balta cieta viela.
Tas ir spēcīgs oksidētājs.
Viegli reaģē ar citām vielām.
Tas nav viegli uzliesmojošs.
Normālos temperatūras un spiediena apstākļos:
- blīvums: 1,73 g / cm³;
- viršanas temperatūra: 210 ° C;
- kušanas temperatūra: 169,6 ° C;
- šķīdības pakāpe ūdenī: 216 g / 100ml;
- pH: 5,5 (0,2 M).
Amonija nitrāta formula
Šī savienojuma molekulārā formula ir NH4PIE3.

Amonija nitrāta sadalīšanās
par to, ka esi a viela ar augstu reaktivitāti un augstu oksidēšanas potenciālu, amonija nitrāts, pakļauts augstai temperatūrai, izraisa a sadalīšanās reakcija, un galvenie produkti ir gāzes, slāpeklis, skābeklis un ūdens tvaiki. Sadalīšana tiek veikta divos posmos:
→ 1. solis:
2NH4PIE3 (s) → 2N2O (g) + 4H2O (g)
→ 2. posms:
2N2O → 2N2g) + O2g)
→ Globālais vienādojums:
2NH4PIE3 (s) → 2N2g) + O2(g) + 4H2O (g)
Ievērojiet, ka pirmajā vienādojumāviens no produktiem sadalīšanās rezultātā iegūtais ir slāpekļa oksīds (N2O), zināms arī kā smieklu gāze. To lieto, lai palielinātu automobiļu dzinēju jaudu, lai sadedzinātu degvielu, un kā anestēzijas līdzekli, galvenokārt zobārstiem. Tas ir arī viena no galvenajām gāzēm, kas atbild par siltumnīcas efekts.
Skatīt arī: Kādi ir ķīmisko reakciju veidi?
Amonija nitrāta ražošana
Amonija nitrātu var iegūt ar reakcija starp amonija sulfātu (NH4)2TIKAI4 un kalcija nitrāts Ca (NO3)2. Skatīt zemāk:
(NH4)2TIKAI4 + Ca (NĒ3)2 → 2 NH4PIE3+ Lieta4
To var ražot arī no gāzveida amonjaka, kas ir burbuļots slāpekļskābes šķīdumā un kura reakcijas produkts ir amonija nitrāta ūdens. Skaties:
NH3. punkta g) apakšpunkts + HNO3 (aq) → NH4PIE3(šeit)
Amonija nitrāta izmantošana

- Mēslošanas līdzekļu ražošana
- Sprāgstvielas raktuvēs, karjeros un būvniecībā
- Herbicīdi un insekticīdi
- Slāpekļa oksīda iegūšana rūpnieciskai izmantošanai
- Absorbenti oksīdiem
- Oksidants raķešu propelentiem
- Izotermisko maisiņu ražošana
- Anestēzijas dūmu ražošana stropu apsaimniekošanai biškopībā
Piekļūstiet arī: Kā cīnīties ar uguni?
Amonija nitrāta bīstamība
Viens no galvenajiem ar amonija nitrātu saistītajiem riskiem ir nepietiekama uzglabāšana. Tā kā tā ir ļoti oksidējoša viela un tā reaģē ar vairākiem citiem savienojumiem, tā izraisa a reakcija ar liela gāzes apjoma izdalīšanos. Nepareiza uzglabāšana ir pakļauta piesārņojumam ar uzliesmojošiem izstrādājumiem, siltuma vai gāzes aiztures iedarbībai, kas var izraisīt sprādzienus.
Tas jau noticis Teksasā, piemēram, ASV ar kravas kuģi, kas ieradās no Francijas un pārvadāja 2086 tonnas amonija nitrāta. negadījums notika 1947. gadā un kļuva pazīstams kā Teksasas pilsētas katastrofa. Traģēdija izraisīja 581 cilvēka nāvi un tas notika ugunsgrēka dēļ, kas nebija kuģī un sasniedza amonija kravu, izraisot sprādzienu.
Vēl viens piemērs bija sprādziena secība kas notika 2020. gada 4. augustā Oostas ostā Beirutas pilsēta, Libāna, atstājot vairāk nekā 100 cilvēku mirušus un 5000 ievainotus. Sprādziena lielums bija saistīts ar tajā uzglabātās 2750 tonnu amonija nitrāta kravas ķēdes reakcijas aizdegšanos.
Ir arī vērts atzīmēt, ka amonija nitrāts var izraisīt ādas un acu kairinājums un, ja ieelpo, elpošanas problēmas. Asinsritē vielai ir toksisks spēks, jo tā reaģē ar ķermeņa šķidrumiem, un šīs reakcijas produkti, piemēram, nitrāts, var kaitēt veselībai, piemēram, zilā mazuļa slimība, pazīstams arī kā zīdaiņu methemoglobinēmija (zems hemoglobīna līmenis asinīs). Šī slimība lauku rajonu ģimenēs atkārtojas lauksaimniecības reģiona ūdenstilpju piesārņojuma dēļ ar amonija nitrātu, kas atrodas mēslošanas līdzekļos.
autors Laysa Bernardes
Ķīmijas skolotājs
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
ARAúJO, Laysa Bernardes Marques de. "Amonija nitrāts"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/nitrato-de-amonio.htm. Piekļuve 2021. gada 27. jūnijam.
Bioloģija
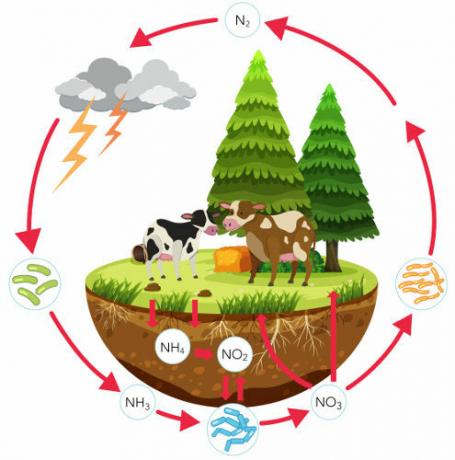
Uzziniet vairāk par slāpekļa ciklu - svarīgu bioģeoķīmisko ciklu, kas nodrošina šī elementa cirkulāciju. Šajā tekstā mēs pievērsīsimies katram slāpekļa cikla posmam, apspriedīsim tā nozīmi un koncentrēsimies uz baktēriju lomu šajā procesā. Mēs arī iepazīstināsim ar vingrinājumiem par šo tēmu.