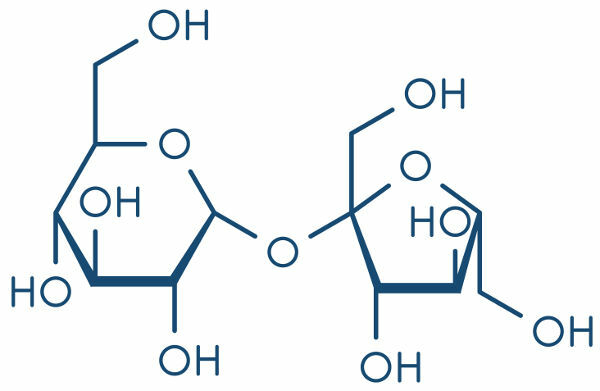
Izomērija tā ir dabiska parādība, kurā dažādām vielām (ķīmisko un fizikālo īpašību ziņā) ir tieši tāda pati molekulārā formula kā šajā piemērā:
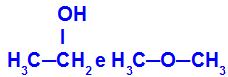
Dažādas vielas, kurām ir vienāda molekulārā formula
Etanolam (pa kreisi) ir molekulārā formula C2H6O, kas notiek arī ar metoksietānu (pa labi), tāpēc tie ir izomēri.
Izomērijas veidi
→ plakans izomērs
Tieši izomērija veids pēta strukturālās atšķirības starp izomēriem.
) Nodarbošanās
Tas ir plakana izomērija veids, kurā atšķirība starp vielām ir balstīta uz atšķirību starp organiskajām funkcijām, kurām tās pieder. Skatiet dažus piemērus:
Propanons un propāns:
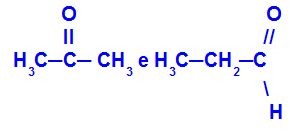
Izomēri, kas pieder dažādām funkcijām
Propanons (pa kreisi) pieder ketonu grupai, un propanāls (pa labi) pieder aldehīdu grupai.
B) Cietums
Tas ir plakanā izomērija veids, kurā atšķirība starp vielām ir balstīta uz atšķirību starp to ķēdēm. Skatiet piemēru:
2-metil-propāns un butāns
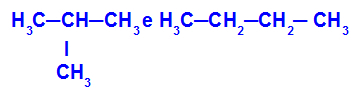
Izomēri, kuriem ir ķēdes ar dažādu klasifikāciju
Piemērā mēs varam redzēt, ka 2-metil-propānam (kreisajā pusē) ir sazarota ķēde, bet butānam (labajā pusē) ir normāla ķēde.
ç) Pozīcija
Tas ir plakana izomērija veids, kurā atšķirība starp vielām ir balstīta uz to ķēdēs esošā komponenta stāvokļa atšķirību. Skatiet piemēru:
1-hlorpropāns un 2-hlorpropāns
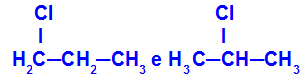
Izomēri, kuru komponenti atrodas dažādās ķēdes pozīcijās
Piemērā mēs varam redzēt, ka 1-hlorpropānā (kreisajā pusē) hlors ir novietots uz oglekļa 1, un 2-hlorpropāna (labajā pusē) hlors ir novietots uz oglekļa 2.
d) Metameria vai kompensācija
PIEZĪME: Izomērija ir derīga tikai neviendabīgām stīgām.
Tas ir plakana izomērija veids, kurā atšķirība starp vielām ir balstīta uz atšķirību to ķēdēs esošā heteroatomā. Skatiet piemēru:
Piemērs: Metoksipropāns un etoksietāns
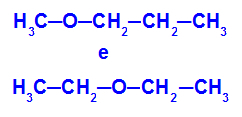
Izomēri, kuriem heteroatomi ir dažādās ķēdes pozīcijās
Piemērā mēs varam redzēt, ka metoksipropānā (pa kreisi) skābeklim ir radikāls, kura vienā pusē ir viens ogleklis un otrā - trīs oglekļa atomi. Etioksietānā (labajā pusē) skābeklim ir radikāls ar diviem ogļiem vienā pusē un diviem ogļiem otrā pusē.
un)Tautomērija
Tas ir īpašs plaknes funkcijas izomērijas gadījums, un tas notiek tikai trīs organiskās funkcijās:
Aldehīds
ketons
Enol
Šāda veida izomērija darbojas ar to, ka starp enolu un aldehīdu, kā arī starp enolu un ketonu pastāv ķīmiskais līdzsvars, tas ir, šie komponenti pastāvīgi pārvēršas savā starpā. Skatiet piemēru:
Prop-2-en-1-ols un propanons
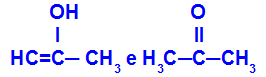
Izomēri, kas pieder dažādām funkcijām
Piemērā mēs varam redzēt, ka Prop-2-en-1-ols (kreisajā pusē) pieder enolu grupai, un propanons (labajā pusē) pieder ketonu grupai, tāpēc tie ir tautomērijas izomēri.
→ Kosmosa izomērija
Tas ir izomērijas veids, ko nosaka molekulas telpiskā analīze.
a) Ģeometriskie izomēri
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Tas ir telpiskā izomērijas veids, kas rodas, ja vielai ir molekulas ar šādām īpašībām:
Slēgta ķēde, kurā ir divi ogļūdeņraži ar diviem dažādiem ligandiem, kā parādīts zemāk esošajā piemērā:

Slēgta struktūra ar ģeometrisku izomēriju
Atvērtā ķēde, kurai ir divkārša saite starp ogļiem, un katrā no šiem dubultās saites ogļiem ir divi dažādi ligandi, kā parādīts zemāk esošajā piemērā:
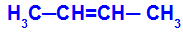
Atvērta struktūra ar ģeometrisku izomēriju
Ģeometriskais izomērijs ir sadalīts divās grupās:
1O Grupa: cis-trans
Tas notiek, ja viena oglekļa divi ligandi ir stingri vienādi ar otra oglekļa diviem ligandiem, neatkarīgi no tā, vai tie atrodas atvērtā vai slēgtā struktūrā.
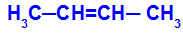
Vielas ķēde, kurai ir cis-trans izomerisms
Izomēru sauks par cis, kad vieni un tie paši ligandi atrodas vienā plaknē.

Cis izomēra piemērs
Izomēru sauks par trans, kad dažādi ligandi atrodas vienā plaknē.

Transizomēra piemērs
2O Grupa: E-Z
Tas notiek, ja viena oglekļa divi ligandi ir atšķirīgi attiecībā pret otra oglekļa diviem ligandiem vai nu atvērtā, vai slēgtā struktūrā.

Vielas ķēde, kurai ir E-Z izomērisms
Izomēru sauks par E, kad ligandi ar vislielāko atomu skaitu atrodas pretējās plaknēs. Zemāk redzamajā piemērā kreisajā pusē esošajam ogleklim ir Br ar visaugstāko atomu skaitu (35), bet otrā - skābeklis (8).
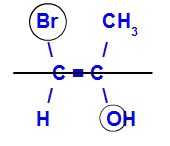
E-izomēra piemērs
Izomēru sauks par Z, kad ligandi ar vislielāko atomu skaitu atrodas vienā plaknē. Zemāk redzamajā piemērā kreisajā pusē esošajam ogleklim ir Br ar visaugstāko atomu skaitu (35), bet otrā - skābeklis (8).

Z-izomēra piemērs
B) optiskais izomērs
Tas ir telpiskā izomērija veids, kas rodas tikai tad, ja vielai ir molekulas ar kirālais ogleklis (tā, kurai ir četri dažādi ligandi) to struktūrās. Molekulai ar kirālo oglekli ir spēja polarizēt un novirzīt gaismu šādi:
Pa labi (labās puses izomērs)
Pa kreisi (pagrieziena izomērs)
Savienojumam ar optisko aktivitāti vienmēr ir aktīvie izomēri (saukti par optiskajiem antipodiem) un neaktīvie izomēri (divu aktīvo izomēru maisījums, maisījums, ko sauc par racēmisko).
Mēs varam izmantot šādu formulu, lai noteiktu aktīvo (IOA) un neaktīvo (IOI) izomēru skaitu savienojumam, kuram ir kirāls ogleklis:
IOA = 2Nē
IOI = 2Nē
2
Zemāk ir savienojuma, kuram ir ģeometriskais izomērijs, piemērs:
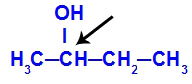
Ķirālais ogleklis ir butān-2-olā
Butān-2-ola struktūrai ir šādi ligandi:
Metilgrupa (CH3)
Etils (CH3-CH2)
Ūdeņradis (H)
Hidroksilgrupa (OH)
Tāpēc, ka tajā ir tikai viens kirālais ogleklis, butan-2-olam ir:
Aktīvie izomēri:
IOA = 21
IOA = 2
Neaktīvi izomēri:
IOI = 21
2
IOI = 2
2
IOI = 1
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Kas ir izomērija?"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Piekļuve 2021. gada 27. jūnijam.