Plkst sadegšanas reakcijas tie ir sastopami daudzos mūsu ikdienas aspektos. Piemēram, galvenie enerģijas ražošanas avoti rodas, sadedzinot vai sadedzinot cita veida degvielu, piemēram, etanolu, benzīnu, kokogles. Turklāt enerģija, kas mums nepieciešama, lai izdzīvotu un veiktu darbu, ir sadegšanas reakciju rezultāts, kas notiek mūsu šūnās, kad mēs “sadedzinām” ēdienu, ko ēdam.
Bet kas vajadzīgs, lai būtu sadegšanas reakcija?
Nepieciešamas trīs lietas:
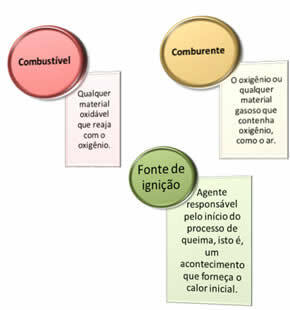
Šie trīs faktori veido uguns trijstūris, jo, tiklīdz sākas sadegšanas reakcija, atbrīvotā enerģija uztur reakciju un ļauj tai turpināties, kamēr degviela, oksidētājs vai siltums (izdalītā enerģija) vairs nav. Tas nozīmē, ka būs a Ķēdes reakcija.
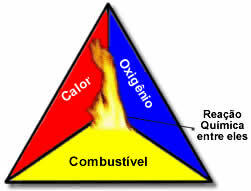
Piemēram, ja kāds mežā iemet aizdedzinātu cigareti, notiks ugunsgrēks (sadegšanas reakcija). Šajā gadījumā Bušs tas ir degviela, O skābeklis, kas atrodas gaisā atmosfēras ir oksidētājs tas ir cigarete iedegās bija aizdegšanās avots. Šī dedzināšana turpināsies, līdz tiks novērsts viens no trim faktoriem. Ja ugunsdzēsēji izmet ūdeni, siltums tiks likvidēts. Bet pat tad, ja nekas netiek darīts, lai apturētu šo dedzināšanu, tas kādā brīdī beigsies, tas ir, kad degviela (mežs) beigsies.
Kā jau minēts, šajās reakcijās tiek atbrīvots siltums, tādējādi sadegšana ir eksotermiska reakcija. Tomēr šāda veida reakcija ir nepilnīga sadegšana. Lai saprastu, kāpēc, skatiet atšķirību starp pilnīgu un nepilnīgu sadedzināšanu:
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Pilnīga sadedzināšana:
Analizējot organiskos savienojumus kā degvielu, mums:
| pilnīga sadegšana tas notiks, kad oglekļa ķēde ir sadalīta un visi oglekļa atomi oglekļa ķēdē ir pilnībā oksidēti. |
| Jūs veidoti produkti ogļūdeņraži būs CO2 (oglekļa dioksīds) un H2O (Ūdens). |
Novērojiet pilnīgu izoktāna sadegšanu, kas ir viena no benzīna sastāvdaļām.
Ç8H18. g) +25/2 O2. punkta g) apakšpunkts → 8 CO2. punkta g) apakšpunkts + 9:002O(1)
Nepilnīga sadegšana
| Šajā gadījumā nepietiek oksidētāja, tas ir, pietiekami daudz skābekļa, lai sadedzinātu visu degvielu. |
| Tādējādi izveidojušies produkti ir CO (oglekļa monoksīds) un H2O. |
Novērojiet to pašu izoktāna sadegšanu, tomēr tagad tas ir nepilnīgs:
Ç8H18. g) + 17/2 O2g) → 8 CO g) + 9:002O(1)
Mežu dedzināšana ir piemērs, jo radušās emisijas sastāv no CO un īpašām vielām, piemēram, kvēpiem (C), kā arī pelniem un citiem vienkāršiem un sarežģītiem organiskiem savienojumiem. Slāpekļa oksīds, ozons un aldehīdi var veidoties arī sekundāru reakciju rezultātā citu komponentu klātbūtnes dēļ gaisā.
Ç8H18. g) + 9/2 O2. punkta g) apakšpunkts → 8C g) + 9:002O(1)
Autore Jennifer Fogaça
Beidzis ķīmiju
Brazīlijas skolu komanda
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Pilnīga un nepilnīga sadedzināšana"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm. Piekļuve 2021. gada 27. jūnijam.