Plkst starpmolekulārie spēki tie ir elektrostatiskās pievilcības spēki, kuru funkcija ir savienot molekulas (molekulārus savienojumus), turot tās cietā vai šķidrā stāvoklī. Tie ir ārkārtīgi svarīgi, jo tie nosaka visas fizikālās īpašības (kušanas temperatūra, viršanas temperatūra, blīvums un šķīdība) vielas.
Šajā tekstā mēs pētīsim saikne starp starpmolekulārajiem spēkiem un vielu viršanas temperatūru. Sākumā atcerēsimies trīs svarīgus starpmolekulāro spēku veidus, kas ir:
♦ dipola dipola: ir spēks, kas rodas polārajās molekulās. Tā kā šīm molekulām ir pozitīvs un negatīvs pols, dipola-dipola spēks ir balstīts uz pievilcību starp vienas molekulas pozitīvo galu un otras negatīvo galu. Piemēri: HCl, HBr, SO2 un PH3
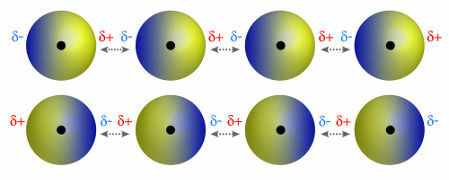
Molekulas, kurām ir pozitīvs un negatīvs pols, piesaista viena otru
♦ Inducēts dipols: ir starpmolekulārais spēks, kas notiek tikai nepolārās molekulās (tām nav polu). Kad tuvojas divas apolāras molekulas, notiek to mākoņu īslaicīga deformācija elektroni, kas izraisa nelīdzsvarotību molekulas elektronos, kuri ir sadalīti a viņai savādāk. Tajā brīdī tiek izveidots īslaicīgs dipols, un molekulai uz brīdi ir pozitīvs un negatīvs pols, kas izraisa pievilcību. Piemēri: CO
2, CH4 un BH3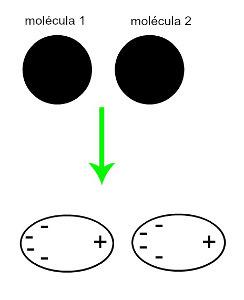
Divu nepolāru molekulu tuvināšana rada deformāciju un līdz ar to elektronu pārdali, kas veido momentānos dipolus
♦ Ūdeņraža saites: tas ir starpmolekulārais spēks, kas notiek polārajās molekulās, bet tikai tajās, kurās obligāti ir ūdeņraža atomi, kas tieši saistīti ar fluora, skābekļa vai slāpekļa atomiem. To var uzskatīt par dipola-dipola spēku, bet ar daudz lielāku intensitāti. Mijiedarbība vienmēr notiek starp vienas molekulas ūdeņradi un citas molekulas atšķirīgo atomu (F, O, N). Piemēri: H2O, NH3 un HF
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
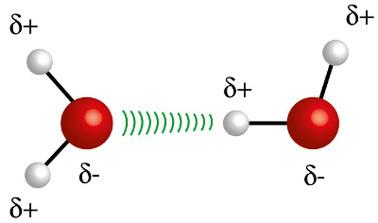
Vienas molekulas ūdeņraža atoms (baltā sfēra) mijiedarbojas ar citas ūdens molekulas skābekli (sarkano sfēru)
Atcerējušies trīs starpmolekulāros spēkus, tagad mēs varam tos saistīt ar vielu viršanas temperatūru. tiek saukts vārīšanās punkts temperatūra, kurā noteiktas vielas molekulas pārstāj būt šķidrā stāvoklī (starpmolekulārie spēki ir salauzti) un pāriet gāzveida stāvoklī. Interesanta detaļa ir tā, ka starpmolekulārie spēki un viršanas temperatūra vielām ir ļoti intensīvas un tiešas attiecības, jo, jo intensīvāks starpmolekulārais spēks, jo augstāka viršanas temperatūra. Starpmolekulāro spēku intensitātes secība ir:
Inducēts dipols
Tādējādi mēs varam secināt, ka molekulām, kurām kā mijiedarbības spēks ir ūdeņraža saites, viršanas temperatūras ir augstākas nekā tām, kurām ir dipola-dipola un tā tālāk. Turpmākajā tabulā ir norādītas trīs vielas un to viršanas temperatūras vērtības:
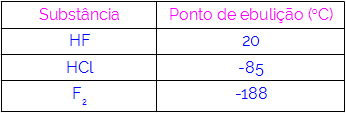
Mēs tabulā novērojam, ka HF viršanas temperatūra ir augstāka, jo tā molekulas savieno ūdeņraža saites. F viela2 tam ir viszemākā viršanas temperatūra, jo tā molekulas piesaista inducēts dipols.
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Starpmolekulārie spēki un vielu viršanas temperatūra"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm. Piekļuve 2021. gada 27. jūnijam.
Ķīmija
Molekulārās vielas, viršanas temperatūra, saskares virsma, viršanas temperatūra, starpmolekulārie pievilkšanās spēki, ķīmiskās saites, molekulārie savienojumi, kovalentās ķīmiskās saites, jonu saites, metāliskās saites, slikti

