entropija ir a varenībatermodinamika saistīts ar neatgriezeniskums no fiziskās sistēmas stāvokļiem. Tas parasti ir saistīts ar "traucējumi”Vai“nejaušībaSistēmas. Saskaņā ar vienu no 2. termodinamikas likums:
“Termiski izolētā sistēmā entropijas mērījumiem vienmēr ir jāpalielinās, līdz tie sasniedz maksimālo vērtību. ”
Citiem vārdiem sakot, entropija spēj izmērīt "laika bultaSistēmas. Redzot zemāk redzamos attēlus, mēs intuitīvi zinām, ka sistēmas sākotnējo stāvokli attēlo sistēmas attēls pa kreisi, no lielākajiem organizācija:
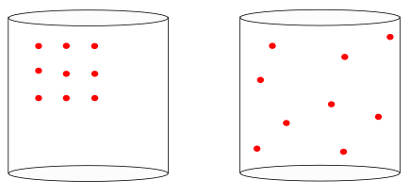
Aplūkojot iepriekšējo attēlu, mēs zinām, ka visticamāk galīgā konfigurācija ir tā, kurā ir atomi ātrumu visos virzienos, kā arī izlases pozīcijas. Par to ir entropija: a daudzveidība no sistēmas stāvokļiem vienmēr jāpalielina.
Piemēri
Kurš no tālāk norādītajiem iestatījumiem ir ticamāk jāievēro ķieģeļu izkārtojums laika gaitā?

Pirmajā konfigurācijā daudzveidība no bloku stāvokļiem ir maz: tie visi ir sakārtoti virzienuhorizontāli, paralēli viens otru. Ar laiku vai aģenta darbību ir sagaidāms, ka tā konfigurācija
pieaudz iekšā numuru iekšā Štatos, atbalstot Pirmdienakonformācija, ilustrēts attēlā labajā pusē. Var minēt citus piemērus:-
Kad ledus saiņu ievieto traukā ar lielākstemperatūra, tā temperatūra paaugstinās, līdz tā sasniedz siltuma bilance. Tajā brīdī ledus var izkust. Atkal ņemot siltumu no ledus bloka, kas tagad ir stāvoklī šķidrums, tas var atkal kļūt ciets, bet tā konformācija nebūs tās pašas organizācijas kas iepriekš tika prezentēts.
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Atverot smaržu pudeli, var palīdzēt siltums difūzija no jūsu molekulas, smaržu satura izkliedēšana visā telpas garumā. Nevar gaidīt pretējo, jo siltuma noņemšana neveicinātu molekulu atgriešanos kolbā.
Entropijas matemātiskā definīcija
matemātiskā definīcija entropiju nosaka siltuma daudzuma attiecība (J), kas pārvietots starp divām siltumizolētas sistēmas daļām, in džoulus (J) pēc absolūtās temperatūras, Kelvins (K):

S = Entropija (J / K)
ΔQ = Siltuma daudzums (J)
T = Absolūtā temperatūra (K)
Iepriekš sniegtā definīcija ir derīga izotermiskie procesitas ir, kurā ir tik mazas (vai lēnas) siltuma apmaiņas, ka tās nespēj mainīt sistēmas temperatūru. Tādēļ entropijas definīcija ir bezgalīgi mazs (bezgalīgi maza daļa).
Mēs varam saprast arī entropijas jēdzienu šādi: būt sistēmai, ko veido divas vienas un tās pašas gāzes daļas, iekšā daudz dažādutemperatūras, ir iespējams iegūt zināmu daudzumu darbs no viņa dažus pārvietojot virzulis vai rokas kloķis, piemēram. Tomēr laika gaitā, šīs gāzes daļām būs tendence līdzsvarstermiskā. Ja vairs nav temperatūras starpības, pat ar visu tajā esošo enerģiju, to nebūs iespējams iegūt darbsnoderīgs no viņa.
Autors Rafaels Hellerbroks
Absolvējis fiziku
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
HELERBROCK, Rafaels. "Kas ir entropija?"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm. Piekļuve 2021. gada 28. jūnijam.