Katra šūna ir ierīce, kurā notiek spontāna oksidēšanās-reducēšanās reakcija, kas rada elektrisko strāvu, kas savukārt tiek izmantota, lai dažas iekārtas darbotos.
Šīs ierīces ieguva savu nosaukumu, jo pirmo izveidoto akumulatoru izgudroja Alesandro 1800. gadā to veidoja cinka un vara diski, kas atdalīti ar iesūcinātu kokvilnu sālījums. Šis komplekts tika novietots savstarpēji, viens virs otra, krājas diskus un veidojot lielu kolonnu. Kā bija a akumulatoru disku, sāka saukt ar šo vārdu.

Baterijas vienmēr sastāv no diviem elektrodiem un elektrolīta. Pozitīvo elektrodu sauc par a katods un šeit notiek samazināšana. Negatīvais elektrods ir anodu un šeit notiek oksidēšanās. Tiek saukts arī elektrolīts sāls tilts un ir jonu vadošais šķīdums.
Lai saprastu, kā tas rada elektrisko strāvu, skatiet viena no pirmajām baterijām - Daniela kaudze, kurā bija trauks ar vara sulfāta šķīdumu (CuSO4 (aq)) un, iemērcot šajā šķīdumā, bija vara plāksne. Citā atsevišķā traukā bija cinka sulfāta (ZnSO4 (aq)) un tuvās cinka plāksnes. Abus šķīdumus savienoja sāls tilts, kas bija stikla caurule ar kālija sulfāta šķīdumu (K.
2TIKAI4 (aq)) ar stikla vati galos. Visbeidzot, abas plāksnes bija savienotas ar ārēju ķēdi ar lampu, kuras apgaismojums norādītu elektriskās strāvas pāreju: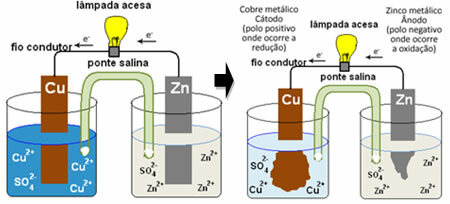
Notiek tā, ka cinkam ir lielāka tendence oksidēties, tas ir, zaudēt elektronus, tāpēc asmens metāliskais cinks darbojas kā negatīvais elektrods, anods, kur notiek oksidēšanās: Zns) ↔ Zn2+(šeit) + 2 un-. Cinka zaudētos elektronus ārējā ķēde transportē uz varu, radot elektrisko strāvu, kas ieslēdz lampu. Šķīdumā esošie vara joni saņem elektronus (reducē) un pārveidojas par metāla varu, kas nogulsnējas uz vara loksnes. Tas nozīmē, ka redukcija notiek ar pozitīvo elektrodu, katodu: Ass2+(šeit) + 2 un- ↔ asss).
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Mūsdienu akumulatoriem ir tāds pats darbības princips, kad viens metāls caur vadošu šķīdumu ziedo elektronus otram, un rodas elektriskā strāva. Atšķirība ir tāda, ka šodien izmantotās baterijas ir sausas, jo tās neizmanto šķidru šķīdumu kā elektrolītu, kā tas notiek Daniell akumulatorā.
Mūsdienās ir ļoti dažādas baterijas, kuras tiek pārdotas komerciāli. Starp tiem visbiežāk ir skābes šūnas (no Leclanché) unalkalīna baterijas.
Abiem negatīvais elektrods ir cinks; no otras puses, kā pozitīvs stabs, kaudzes vidū ir uzstādīta grafīta josla, ko ieskauj mangāna dioksīds (MnO2), ogļu pulveris (C) un mitra pasta. Atšķirība ir tāda, ka skābā kaudzē mitrā pastā izmanto amonija hlorīdu (NH).4Cl) un cinka hlorīds (ZnCl2- skābie sāļi - papildus ūdenim (H2O). Sārmainā akumulatorā tiek izmantots kālija hidroksīds (KOH), kas ir pamats.

Leclanché baterijas ir vislabāk piemērotas iekārtām, kurām nepieciešama viegla un nepārtraukta izlāde, piemēram, tālvadības pults, sienas pulkstenis, pārnēsājamais radio un rotaļlietas. Savukārt sārma baterijām ir par 50 līdz 100% vairāk enerģijas nekā parastam tāda paša izmēra akumulatoriem. nepieciešama ātrāka un intensīvāka lejupielāde, piemēram, radio, CD / DVD atskaņotāji, pārnēsājami MP3, lukturīši, digitālās fotokameras utt.

Uzziniet vairāk par to, kādi elektrolīti un elektrodi tiek izmantoti arī šo un cita veida baterijās. par to, kāda veida aprīkojumu tie ir visvairāk ieteicami, lasiet vairāk saistītos rakstus bildēt.
Autore Jennifer Fogaça
Beidzis ķīmiju

