Atomu skaitlis, ko simbolizē burts Z, atbilst protonu daudzumam, kas eksistē noteiktā ķīmiskā elementa atoma kodolā. Piemēram, ūdeņraža atomu skaits ir 1, kas nozīmē, ka tā atoma kodolā ir tikai 1 protons.
Atomu skaitlis parasti parādās blakus ķīmiskā elementa apakšraksta simbolam (apakšējā stūrī) kreisajā pusē. Piemērs: 1H.
Pamatstāvoklī atomu skaitlis ir vienāds ar elektronu skaitu, jo šajā stāvoklī elements ir neitrāls, tāpēc pozitīvo lādiņu (protonu) daudzumam jābūt vienādam ar negatīvo lādiņu (elektronu) daudzumu atoms.
Atomu skaitlis ir svarīgs, jo tas ir tas, kurš nosaka elementa galvenās īpašības un īpašības, kā arī tā uzvedību un atrašanās vietu periodiskajā tabulā. Elementi ir uzskaitīti periodiskajā tabulā augošā atomu skaita secībā, kas parasti parādās virs elementa, kā parādīts zemāk. Ņemiet vērā, ka pirmais elements ir ūdeņradis, H (Z = 1), kam seko hēlijs, He (Z = 2), pēc tam nāk litijs, Li (Z = 3) utt.
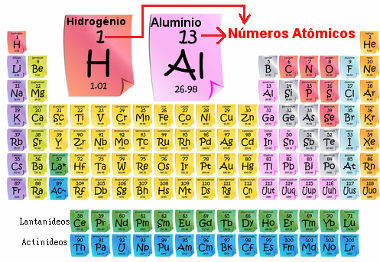
Elementu atomu skaits periodiskajā tabulā
Mēs pat varam konceptualizēt ķīmisko elementu kā tādu
“Atomu kopa, kurai ir vienāds atomu skaitlis”. Tādējādi, runājot, piemēram, par ķīmisko elementu skābekli, mēs runājam par atomiem ar atomu skaitli 8. Zemāk mums ir ķīmisko elementu atomi no periodiskās tabulas 1. un 2. perioda atomu skaita augošā secībā:
Ķīmiskie elementi no periodiskās tabulas 1. un 2. perioda atomu skaita augošā secībā
Sākotnēji atomu numurus noteica angļu fiziķis Henrijs Gvins Džefrijs Moselijs (1887–1915) un, veicot eksperimentus, kas saistīti ar dažādu elementu bombardēšanu ķīmiķi ar rentgena stariem viņš novēroja, ka rentgenstaru frekvences kvadrātsakne, ko rada atomu kodola emisija, ir tieši proporcionāla tabulas elementa atoma skaitam. Periodiski. Ar to viņš secināja, ka atoma skaitlis ir saistīts ar atomu īpašībām, jo tas atspoguļo pozitīvo lādiņu skaitu katra atoma kodolā.
Ķīmiskās saites neietekmē atomu atomu skaitu, jo tajās piedalās tikai elektroni, kas atrodas elektrosfērā. Tomēr kodolreakcijas ir saistītas ar atomu kodolu, tāpēc tiek iekļauts arī atomu skaits.
Piemēram, kad daļiņas (galvenokārt mēreni neitroni) tiek bombardētas uz smagu, nestabilu atomu kodolu, šis kodols tiek sadalīti un rada divus mazākus atomu kodolus, tas ir, ar mazāku protonu un neitronu skaitu, atbrīvojot kolosālu daudzumu enerģija.
Savukārt kodolsintēze ir pretējs process, tas ir, kad apvienojas divi mazi un gaiši kodoli, radot lielāku un stabilāku kodolu, atbrīvojot vēl lielāku enerģijas daudzumu.
Tādējādi vienmēr, kad notiek šīs kodolreakcijas, rodas jauni ķīmiskie elementi, jo sākotnējo elementu atomu skaitļi atšķiras no galīgo elementu atomu numuriem. Piemēram, zemāk skatiet, ka urāna-235 sadalīšanās ar atomu numuru 92 rada bāriju (Z = 56), kriptonu (Z = 36) un trīs neitronus:

Urāna-235 kodola skaldīšanas reakcija
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm

