Saskaņā ar orbītu modeli, ko 1960. gadā izveidoja Linuss Polings, kovalentā saite, kas veido molekulas rodas, saplūstot vai savstarpēji iekļūstot nepilnīgo orbitāļu elementos, kas iesaistīti Saite. Tādējādi tiek secināts, ka, ja elementam ir nepilnīga orbitāle (tikai ar vienu elektronu), tas var izveidot tikai kovalento saiti. Ja tam ir divas nepilnīgas orbitāles, tas var izveidot ne vairāk kā divus savienojumus utt.
Tomēr apskatiet elementa oglekļa atoma atomu orbitāles, kuras atoma skaitlis ir vienāds ar 6 (Z = 6):
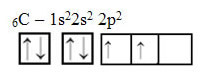
Ņemiet vērā, ka tai ir divas nepilnīgas orbitāles, tāpēc tai vajadzētu veikt ne vairāk kā divas saistīšanas. Tomēr tas nenotiek ar viņu. Kā daudzi zina, ogleklis izveido četras saites (tā ir četrvērtīga), tāpēc šis orbitāļu modelis nepaskaidro oglekļa gadījumu.
Lai izbeigtu šo strupceļu, tika izveidota jauna teorija, kas labāk izskaidroja šo jautājumu: Hibridizācijas teorija.

Tas nozīmē, ka hibridizācija ir tīru orbitāļu “sajaukums”.
Attiecībā uz oglekli ir trīs hibridizācijas veidi, kas ir: sp3, sp2 un sp.
Lai saprastu, kā notiek hibridizācija, aplūkosim pirmo oglekļa hibridizācijas veidu - sp veidu.3:
Šis hibridizācijas veids notiek metāna molekulā (CH4). Ņemiet vērā, ka starp oglekli, kas ir centrālais elements, un četriem ūdeņražiem ir četras identiskas kovalentās saites. Tātad, redziet, kas ir nepilnīga ūdeņraža orbīta:
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
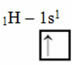
Tā kā katram ūdeņradim ir nepilnīga s veida orbīta, ir nepieciešams saņemt vēl vienu elektronu, tas ir, katrs ar oglekli veido tikai vienu kovalento saiti. Tāpēc ogleklim jābūt četrām nepilnīgām orbitālēm. Kā tas notiek? Caur hibridizāciju.
Kad elektrons no 2s orbitāles absorbē enerģiju, tas pāriet tukšajā 2p orbitālā. Tādējādi mēs sakām, ka šis elektrona lēciens no 2s uz 2p apakšlīmeni ir elektrona “veicināšana”. Tādā veidā ogleklis paliek ierosinātā vai aktivētā stāvoklī, un kovalento saišu veikšanai ir pieejamas četras hibridizētas orbitāles:
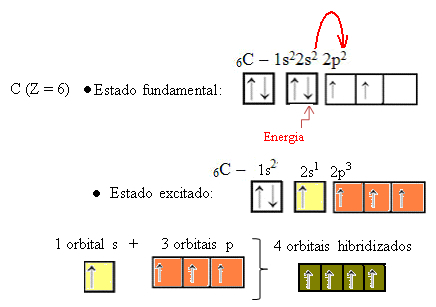
Ņemiet vērā, ka izveidotās hibrīdās orbitāles ir līdzvērtīgas viena otrai, bet atšķiras no sākotnējām tīrajām orbitālēm.
Tādā veidā saikne starp katra četru ūdeņraža atomu s orbitālu notiek ar šīm četrām hibridizētajām oglekļa orbitālēm:
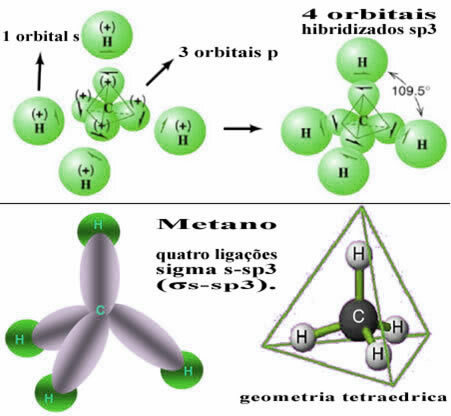
Kā redzams iepriekš, metāna molekulai ir regulāra tetraedru struktūra ar četriem elektronu mākoņiem katrā virsotnē un blakus esošajiem leņķiem 109 ° 28 ’. Tā kā saikne tika izveidota starp katra ūdeņraža s orbitālu un hibridizētu sp orbitālu3 katram savienojumam, tad mums ir, ka viņi ir četras sigmas s-sp saites3 (σs-sp3).
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Sp3 tipa hibridizācija"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm. Piekļuve 2021. gada 28. jūnijam.
