Akumulators tā ir sistēma, kurā ķīmiskā enerģija spontāni tiek pārveidota par elektrisko enerģiju.
1836. gadā angļu ķīmiķis un meteorologs Džons Frederiks Daniels (1790-1845) uzcēla kaudzi, kas atšķiras no tajā laikā zināmās: Alesandro Volta kaudzi. Šajā kaudzē viņš savstarpēji savienoti divi elektrodi, kas bija sistēmas, kas sastāv no metāla, kas iegremdēts sāls ūdens šķīdumā, ko veido šī metāla katijoni.
Viens no elektrodiem, vara elektrods, sastāvēja no vara plāksnes, kas iemērkta vara sulfāta šķīdumā (CuSO4). Otrs elektrods bija cinka elektrods, kas sastāvēja no cinka plāksnes, kas iegremdēta cinka sulfāta (ZnSO4) šķīdumā.
Šie divi elektrodi bija savienoti ar elektrisko ķēdi, kurā atradās lampa, jo, ieslēdzoties, tas liecinātu par elektriskās strāvas rašanos.
Starp tiem bija arī sāls tilts. Šis tilts sastāvēja no U veida stikla caurules, kas satur koncentrētu labi šķīstoša sāls ūdens šķīdumu, piemēram, kālija hlorīdu (KCl (aq)). Caurules gali ir pārklāti ar kokvilnu vai agaru.
Zemāk mums ir šīs šūnas vai elektroķīmiskās šūnas struktūra, kas kļuva pazīstama kā Daniell šūna. Atceroties, ka katru elektrodu sauc par pusi šūnu.
Kad ķēde ir slēgta, lampa ieslēdzas un pēc kāda laika cinka plāksne ir sarūsējusi un tās masa ir samazinājusies, savukārt vara plāksne ir pretēja, tās masa palielinās (kā parādīts attēlā zemāk). Tiek arī atzīmēts, ka palielinās Zn jonu koncentrācija mol / L2+ un Cu jonu samazināšanās2+.
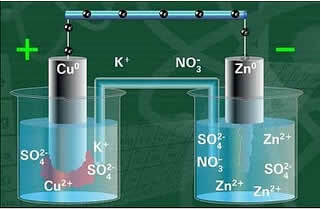
Daniell's Stack shēma.
Kāpēc tas notiek?
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Lai saprastu, apskatīsim reakcijas, kas notiek pie katra elektroda atsevišķi.
Cinka elektrodā notiek šāda līdzsvara reakcija:
Zn (s) ↔ Zn2+(šeit) + 2 un-
Tas nozīmē, ka metāla cinks (no plāksnes) tiek oksidēts, tas ir, tas ziedo divus elektronus cinka katjonam (no šķīduma) un kļūst par Zn2 +. Notiek arī pretējais, šķīdumā esošais cinka katjons uztver divus cinka ziedotos elektronus un kļūst par metāla cinku. Tāpēc notiek nepārtraukts oksidēšanās un reducēšanās process.
Tas pats attiecas uz vara elektrodu, kura dinamiskā līdzsvara reakcija būs globāla: Cu (s) ↔ Cu2+(šeit) + 2 un-
Daniels saprata, ka, ja viņš savienotu šos divus elektrodus, reaktīvākais ziedotu savus elektronus mazāk reaktīvajam katjonam, nevis darītu to ar katjoniem savā šķīdumā. Šajā gadījumā cinks ir visreaktīvākais un oksidējas, ziedojot elektronus varam, līdz ar to tā masas samazināšanās. Elektrods, kas tiek oksidēts, ir negatīvais pols, ko sauc par anodu. Vara elektrods ir tas, kas tiek reducēts, vara katjons saņem divus elektronus no cinka un tiek saukts par katodu (pozitīvo polu).
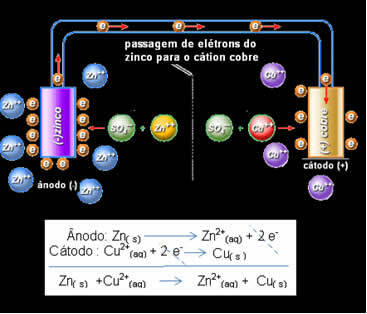
Elektronu pāreja un Daniell's stack globālais vienādojums.
Virs mums ir šīs kaudzes globālais vienādojums, ko iegūst, saskaitot abas pusreakcijas. Tās attēlojums vai ķīmiskais apzīmējums tiek veikts saskaņā ar šādu noteikumu:

Tātad mums ir Daniell steka:
Zn / Zn2+// Ass2+ / ass
Autore Jennifer Fogaça
Beidzis ķīmiju
Brazīlijas skolu komanda
Fizikāli ķīmiskā - Ķīmija - Brazīlijas skola
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Danila kaudze"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Piekļuve 2021. gada 28. jūnijam.



