Saites un molekulas polaritāte ir saistīta ar elektronu sadalījumu ap atomiem.Ja šis sadalījums ir simetrisks, molekula būs nepolāra, bet, ja tā ir asimetriska, un vienai no molekulas daļām ir lielāks elektronu blīvums, tātad tā ir polārā molekula.
Molekulu polaritāti var vizualizēt, kad to sastāvdaļa tiek pakļauta ārējam elektriskajam laukam. Ja molekulas orientējas šī lauka klātbūtnē, tas ir, ja vienu daļu piesaista pozitīvais pols, bet otru molekulas daļu - negatīvais, tad, tie ir polāri. Pretējā gadījumā ja viņi nav orientējušies, viņi ir nepolāri.
Piemēram, daudz berzējot stikla nūju ar flaneli, tā kļūst pozitīvi uzlādēta. Ja mēs tuvosimies tam ūdens plūsmai, kas krīt no jaucējkrāna, mēs redzēsim, ka ūdens neturpinās krist taisnā vertikālā trajektorijā, bet to piesaistīs nūja, ciešot novirzi. Tas parāda, ka ūdens ir polārs. Bet, ja mēs izdarīsim šo pašu eksperimentu ar eļļas fileju, tā nenovirzīsies savā trajektorijā, parādot, ka tās molekulas ir nepolāras.
Analizējot molekulu struktūras, mēs varam noteikt, vai tās ir polāras vai nav, ņemot vērā divus svarīgus faktorus:
elektronegativitātes atšķirība starp atomiem un molekulas ģeometriju.1.) Elektronegativitāte starp atomiem:
Ja molekulu veido saites starp to pašu ķīmisko elementu atomiem, tas ir, ja tās ir vienkāršas vielas, piemēram, O2, H2, Nē2, Cℓ2, P4, S8utt., tie būs nepolāri, jo starp viņu atomiem elektronegativitātē nav atšķirību.
Vienīgais izņēmums ir ozona molekula (O3), kas būs redzams vēlāk.
Ja molekula ir diatomiska un to veido dažādu elektronegativitāšu elementi, tad molekula būs polāra. Piemēri: HCℓ, HF, HBr un HI.
2.) Molekulas ģeometrija:
Molekulas ģeometrija ietekmē to, kā elektroni tajā sadalīsies, un līdz ar to arī tās polaritāti. Ja molekulu veido trīs vai vairāk atomu, mums būs jāanalizē katra izveidotā saite un molekulas ģeometrija. Skatīt piemēru: CO2 - lineāra molekula:
δ- δ+ δ-
O = C = O
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Ņemiet vērā, ka skābeklis ir vairāk elektronegatīvs nekā ogleklis, tāpēc saites elektronus vairāk piesaista skābeklis. Tajos veidojas daļējs negatīvs lādiņš (δ-), savukārt ogleklī veidojas daļējs pozitīvs lādiņš (δ+). Tiek saukts attāluma reizinājums ar atomu kodoliem, kas moduļos savienoti ar šiem lādiņiem (tas ir, tikai skaitlis bez plus vai mīnus zīmes). dipola moments un to pārstāv μ.
μ = d. |δ|
Šo dipola momentu norāda bultiņas, kas norāda elektrononegatīvākā elementa virzienā, kas piesaista elektronus: O ← C → O. Tas parāda, ka šis lielums ir vektors (lielums, kura lielums vai intensitāte, virziens un virziens). Tāpēc to vislabāk attēlo:  .
.

Saskaitot visus vektorus, mēs atrodam iegūto dipola momentu, 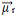 , kas šajā gadījumā bija vienāds ar nulli, jo abiem dipola momentiem ir vienādas vērtības, bet tie iet pretējos virzienos, atceļot viens otru.
, kas šajā gadījumā bija vienāds ar nulli, jo abiem dipola momentiem ir vienādas vērtības, bet tie iet pretējos virzienos, atceļot viens otru.
Kad iegūtais dipola momenta vektors ir vienāds ar nulli, molekula ir nepolāra, bet, ja tā ir nulle, tā būs polāra.
Tāpēc CO molekulas gadījumā2, viņa ir apolāra.
Tagad aplūkojiet citu piemēru: H2O - leņķiskā ģeometrija (jo skābeklim visattālākajā līmenī ir pieejami divi elektronu pāri, kas atbaida elektronus no saitēm ar ūdeņražiem)
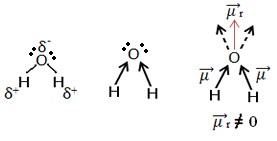
Elektronus piesaista skābeklis. Bet šajā gadījumā vektori neatceļ viens otru, jo ūdens molekulārā ģeometrija ir leņķiska, jo tā virzieni nav pretēji, dodot nulles rezultātā iegūto dipola momenta vektoru, un tāpēc ūdens molekula ir polārs.
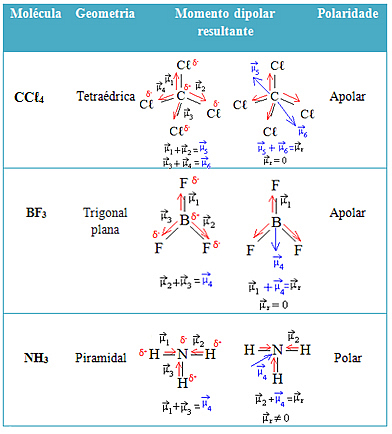
Vairāk piemēru skatiet zemāk esošajā tabulā:
Autore Jennifer Fogaça
Beidzis ķīmiju


