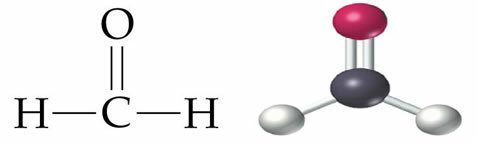Plkst ķīmiskās formulas ir attēli, kurus izmanto, lai norādītu, kuri ķīmiskie elementi ir vielas sastāva sastāvdaļa, kā arī lai attēlotu mijiedarbības veidu starp iesaistītajiem atomiem.
Analizējot ķīmiskās vielas formula, mēs varam noteikt ķīmisko saišu raksturu (jonu, kovalents vai metāla), kas to veidoja, kā arī tā fizikāli ķīmiskā izturēšanās. Dažas īpašības, kas saistītas ar vielas fizikāli ķīmisko uzvedību, ir:
Šķīdība
Kodolsintēzes punkts
Vārīšanās punkts
Reaktivitāte
Tagad zināt savienojumu veidus, kas veido ķīmiskās vielas, un arī formulas, kas tos pārstāv.
Savienojumu veidi
) jonu savienojumi
Jonu savienojumi ir visas ķīmiskās vielas, kas veidojas, joniem saistoties starp atomiem, tas ir, šajos savienojumos ir atomi, kas zaudē, un atomi, kas iegūst elektronus. Ķīmisko elementu kombinācija, kas veido šāda veida savienojumu, var būt:
Metāls ar ametal
Metāls ar ūdeņradi
b) Kovalenti savienojumi
Kovalenti savienojumi ir visas ķīmiskās vielas, kas veidojas, kovalenti saistoties starp atomiem, tas ir, šajos savienojumos ir atomi, kas savstarpēji dala elektronus. Ķīmisko elementu kombinācija, kas veido šāda veida savienojumu, var būt:
ametal to ametal
Ametāls ar ūdeņradi
ūdeņradis ar ūdeņradi
c) Metāla savienojumi
Metāla savienojumi ir visas ķīmiskās vielas, ko veido viena metāla elementa atomi. Šajos savienojumos atomi savstarpēji dala tikai elektronus.
Jonu savienojumu formulas
) jonu formula
Formula jons norāda atomu skaitu, kas veido savienojuma jonu vienību, tāpat kā hlorīda gadījumā nātrija, kura formulas jons ir NaCl. Formulā mēs identificējam nātrija atoma un hlors.
Lai izveidotu jonu formulu, vienkārši sakrustojiet katra jonu lādiņu, kas veido jonu savienojumu. Par Al katjonu+3 un anjonu O-2, piemēram, šķērsojot lādiņus un neņemot vērā signālus, mums ir šāda jonu formula:

b) Elektroniskā formula
Elektronisko formulu izmanto, lai attēlotu savienojuma veidošanā iesaistīto atomu elektronu zudumus un ieguvumus. Ap katra elementa saīsinājumu mums ir katrs no valences slāņi.
Nātrija hlorīda (NaCl) gadījumā Na mums ir tikai viens valences elektrons (jo tas ir no IA ģimenes), un Cl mums ir septiņi valences elektroni (jo tas ir no VIIA ģimenes).

NaCl elektroniskā formula
Elektrona pieaugumu ar Cl (nemetālu) un elektrona zudumu ar Na (nemetālu) attēlo bulta. Saskaņā ar okteta teorija, Na zaudē elektronu, jo tam ir tikai viens, un Cl iegūst vienu, lai pabeigtu astoņus valences elektronus.
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Kovalentiem savienojumiem
a) Molekulārā formula
Molekulārā formula tiek izmantota, lai vienkāršotā formā attēlotu kovalentu vielu. Ūdens molekulārā formula, kas ir H2Piemēram, O ir divi ūdeņraža atomi un viens skābekļa atoms.
Atšķirībā no jonu savienojumu jonu formulas, kovalentā savienojuma molekulārā formula nav veidota ar tik lielu daudzumu vienkāršība, jo dažādu to pašu elementu atomu daudzums veido dažādas vielas, piemēram, ūdeni (H2O) un ūdeņraža peroksīds (H2O2).
Vingrinājumos molekulārā formula ir ļoti izplatīta:
Nodrošina pats vingrinājums;
Jānosaka, izmantojot aprēķinu;
Nosaka, skaitot katru elementu no strukturālās formulas;
Nosaka pēc vielas nosaukuma.
b) Strukturālā formula
Kovalentās vielas strukturālo formulu izmanto, lai attēlotu saišu skaitu, ko katrs molekulas atoms veido. Strukturālajā formulā tiek izmantotas šādas saites:
Viena saite: apzīmē ar domuzīmi (─), norāda vienu saiti;
Divkāršā saite: apzīmē divas domuzīmes (=), norāda divas saites;
Trīskāršā saite: apzīmē trīs domuzīmes (≡), norāda trīs saites;
datējošā saite: apzīmē ar bultiņu (→), norāda vienu savienojumu.
Kovalento savienojumu strukturālā formula, kad vien iespējams, jāatspoguļo atbilstoši attiecīgās molekulas molekulārajai ģeometrijai. Skatiet amonjaka strukturālās formulas attēlojumu, kam ir piramīdveida ģeometrija:

c) Elektroniskā formula
Kovalentā savienojuma elektroniskā formula parāda elektronu dalīšanos starp atomiem, kas veido molekulu. Strukturālajā formulā izmantoto domuzīmju vietā mēs izmantojam sfēras, lai attēlotu elektronus, kas ir kopīgi starp atomiem. Skaties:
Viena saite: divu elektronu dalīšana (pa vienam no katra iesaistītā atoma);
Dubultā saite: dalot četrus elektronus (divus no katra iesaistītā atoma);
Trīskāršā saite: sešu elektronu koplietošana (trīs no katra iesaistītā atoma);
Datīva saite: divu elektronu (abi ir no viena atoma starp iesaistītajiem) koplietošana,
Tādējādi amonjaka, kura strukturālā formula tika attēlota iepriekš, tā elektroniskā formula ir:

Metāla savienojumiem
Metālu savienojumiem, jo tos veido tikai viena metāla atomi, kā ķīmiskā formula ir ķīmiskā elementa saīsinājums:
Vara viela: Cu
Zelta viela: Au
Dzelzs viela: Fe
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Ķīmisko vielu formulas"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/formulas-substancias-quimicas.htm. Piekļuve 2021. gada 27. jūnijam.