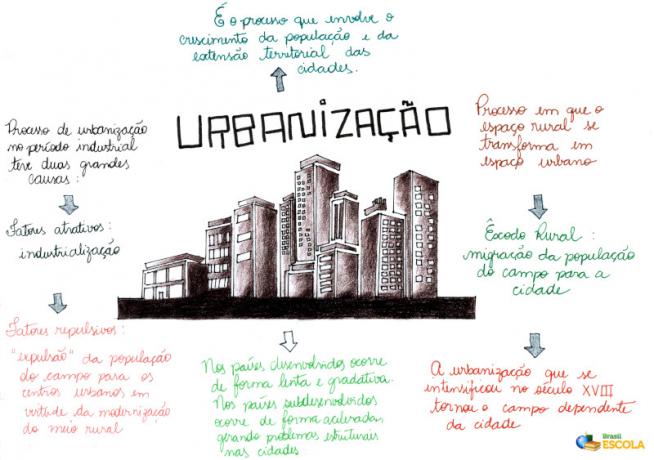
Kps ir saīsinājums, ko lieto, lai apzīmētu šķīdības produkta konstante, kas attiecas uz produkta (reizināšanas) vērtību koncentrācijas vielas daudzumā no šķīdumā esošajiem joniem.
Ikreiz, kad šķīdinātājam, piemēram, bārija sulfātam, pievieno slikti šķīstošo izšķīdušo vielu, nelielu daudzumu šķīduma daļa no šī sāls izšķīst ūdenī, un pārējais uzkrājas trauka apakšā, veidojot fons. Cieš sāls, kas izšķīst disociācija, izdalot ūdenī katjonus un anjonus.

Nogulsnes atrodas šķīdumā ar ūdeni un bārija sulfātu
Bez tam sāls nav labs šķīdība, izšķīdušās izšķīdušās vielas daudzums laika gaitā nemainās, jo starp sāls joniem (šķīdumā esošajiem) un fona ķermeni ir izšķīdināšanas līdzsvars.

BaSO izšķīdināšanas atlikums4 ūdenī
Kps izšķīdušās vielas
O Kps izšķīdušās vielas ir iesaistīto jonu molārās koncentrācijas reizinājums. Vienmēr ir nepieciešams paaugstināt jonu koncentrāciju līdz attiecīgajam stehiometriskajam koeficientam (ko izmanto vienādojuma līdzsvarošanai).

Elektrolīta Y izšķīdināšanas līdzsvarsTheXB
O Kps no ierosinātā sāls Y līdzsvaraTheXB tam būs reaģenta Y koncentrācija (paaugstināta līdz tā stehiometriskajam koeficientam (a) un produkta X koncentrācija (paaugstināta līdz tā stehiometriskajam koeficientam (b)).
Kps = [Y+ b]The. [X-The]B
Piemērs
Pieņemsim, ka mēs gatavojam šķīdumu ar ūdeni un alumīnija cianīdu [Al (CN)3], kas ir praktiski nešķīstošs sāls ūdenī. Kad šo sāli pievieno ūdenim, tas galu galā cieš no disociācijas parādības.

Al (CN) elektrolītu šķīdināšanas līdzsvars3
Tātad, izmantojot sāls šķīdināšanas līdzsvara vienādojumu, mums ir tā Kps alumīnija katjona (Al+3) līdz cianīda anjona (CN-1) paaugstināts līdz 3. eksponentam.
Kps = [Al+3]1[CN-1]3
Kps izšķīdušās vielas nozīme
Kad atrodam Kps no konkrēta sāls, kas sajaukts ar ūdeni, mēs zinām arī katra jonu koncentrāciju šķīdumā. Izmantojot šos datus, mēs varam noteikt šķīduma rangu vai izšķīdušās vielas uzvedību šķīdumā. Apsveriet šādu bilanci:
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)

Elektrolīta Y izšķīdināšanas līdzsvarsTheXB
Mēs varam izveidot šādas attiecības:
Ja Kps = [Y+ b]The. [X-The]B = 0, mums ir piesātināts šķīdums bez nogulsnēm;
Ja Kps> [Y+ b]The. [X-The]B = 0, mums ir nepiesātināts šķīdums, tas ir, maz šķīdinātāja, kas izšķīdināts šķīdinātājā (attiecībā pret šķīdības koeficients);
Ja Kps + b]The. [X-The]B = 0, mums ir piesātināts šķīdums ar ķermeņa dibenu, tas ir, būs elektrolīta (izšķīdušās vielas) nogulsnes;
Ja elektrolīta Kps vērtība ir pārāk zema, tas ir šķīdinātājā slikti šķīstošs materiāls.
Piemērs Kps aprēķins izšķīdušās vielas
(UERN): Kalcija nitrāta [Ca (NO3)2] ūdenī ir 2,0. 10–3 mol / litrs noteiktā temperatūrā. Šī sāls Kps tajā pašā temperatūrā ir:
a) 8.10–8.
b) 8.10–10.
c) 3.2.10–10
d) 3.2.10–8
Vingrinājumu dati:
Sāls formula: Ca (NO3)2;
Molārā sāls koncentrācija (šķīdība): 2,0. 10–3 mol / L.
Lai atrisinātu un aprēķinātu Kps, jums jādara šādi:
1. darbība: Iestatiet sāls šķīdināšanas līdzsvaru.

Kalcija nitrāta šķīdināšanas līdzsvars ūdenī
Kalcija nitrāts, disociējoties ūdenī, izdala 1 mol kalcija katjonus (Ca+2) un 2 mol nitrāta anjonu (NO3-1).
2. darbība: Salieciet sāls Kps izteiksmi
Šī sāls Kps būs kalcija katjona koncentrācijas produkts, ko paaugstina līdz 1. eksponentam ar 2. eksponentam paaugstinātā nitrāta anjona koncentrāciju, kā parādīts zemāk:
Kps = [Ca+2]1.[PIE3-1]2
3. solis: Nosaka jonu koncentrācijas vērtības šķīdumā
Lai aprēķinātu Kps, mums ir nepieciešamas jonu koncentrācijas vērtības, tomēr vingrinājums nodrošināja sāls molaritāti šķīdumā. Lai noteiktu katra jona koncentrāciju, vienkārši reiziniet sāls molaritāti ar reakcijas dalībnieka stehiometrisko koeficientu:
Kalcija katjonam:
[Šeit+2] = 1. 2,0. 10–3
[Šeit+2] = 2,0. 10–3 mol / L
Nitrāta anjonam:
[PIE3-1] = 2. 2,0. 10–3
[PIE3-1] = 4,0. 10–3 mol / L
4. solis: Izmantojiet koncentrācijas vērtības, kas konstatētas 3. solī Kps izteiksmē (noteiktas 2. solī).
Kps = [Ca+2]1.[PIE3-1]2
Kps = [2,10-3]1.[4.10-3]2
Kps = 2,10-3.16.10-6
Kps = 32,10-9
vai
Kps = 3,2.10-9 (mēnesis / l)
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Kas ir Kps?"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm. Piekļuve 2021. gada 27. jūnijam.
Kas ir ķīmija?

Saprotiet, kas ir Kp, līdzsvara konstante spiediena ziņā, un zināt, kā to iegūt, izmantojot spiedienus visu ķīmiskajā līdzsvarā esošo gāzu daļiņas, kas var būt atmosfērā (atm) vai dzīvsudraba staba milimetros (mmHg). Noklikšķiniet šeit un uzziniet vairāk par šo tēmu!