Kad mēs runājam par pH, mēs atsaucamies uz šķīduma hidrogenēšanas potenciālu, tas ir, uz hidronija katjonu daudzumu (H+ vai H3O+), kas ir izkliedēti šķīduma šķīdinātājā.
Hidronija katijoni ir labi zināmi zinātnieka ierosinātās definīcijas dēļ Arhenius par skābi. Šis zinātnieks to apgalvo skābe vai katra viela spēj jonizēt un ūdens vidē ražo hidronija jonus.
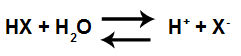
Skābās jonizācijas vienādojums
saīsinājums pH kalpo kā atskaite barotnes skābuma līmeņa noteikšanai. Bet ilgu laiku arī ķīmiķi ir lietojuši pH kā atsauci, lai papildus skābumam noteiktu, vai barotne ir bāziska vai neitrāla.
Tas ir iespējams, jo ķīmiķi tagad apzinās, ka ūdenī notiek pašjonizācija, tas ir, tas ražo hidronijus (H+) un hidroksīdi (OH-). Tādējādi ūdens šķīdumā nekad nav tikai hidronija vai hidroksīda, bet abi, kā redzams no šāda vienādojuma:

Ūdens autoionizācijas vienādojums
Vērtības, ko izmanto kā atskaites punktu pH
Vērtības, kas izmantotas pH attiecas uz ūdens jonizācijas konstanti (Kw) 25 ° C temperatūrāOC, kas ir vienāds ar 10
-14. Šajā temperatūrā ūdens radīto hidronija un hidroksīda jonu koncentrācija ir absolūti vienāda, tas ir, 10-7 mol / L.[H+] = [OH-]= 10-7
No šīs atsauces pH vērtības tiek izmantotas no 0 līdz 14.
PH aprēķināšanas formulas
a) Aprēķins pēc hidronija katjonu koncentrācijas mol / L
PH vērtību var aprēķināt tieši, ja vien mēs zinām hidronija koncentrāciju ([H+]). Skaties:
pH = -log [H+]
vai
10-H = [H+]
b) Aprēķins pēc hidroksīda anjonu (OH-)
pOH = -log [OH-]
vai
10-OH = [OH-]
Pēc pOH vērtības aprēķināšanas jums tas jāizmanto šajā izteiksmē, lai noteiktu pH vērtību.
pH + pOH = 14
PH vērtību interpretācija
Zinot pH vērtību, mēs varam noteikt, vai attiecīgajam šķīdumam ir skābs, bāzisks vai neitrāls raksturs. Lai to izdarītu, vienkārši izmantojiet šādas shematiskās attiecības:
PH vērtībām zem 7 = skāba vide;
PH ar vērtību, kas vienāda ar 7 = neitrāla vide;
PH vērtībām virs 7 = bāzes barotne.
Piemēri
1. piemērs: Zinot, ka hidronija katjonu koncentrācija šķīdumā ir 2,10-4 mol / L, kādai jābūt šī šķīduma pH vērtībai?
Lai noteiktu šķīduma pH vērtību no hidronija (H+), 2.10-4 mol / L, mums jāizmanto šāda izteiksme:
pH = -log [H+]
pH = -log [2,10-4 ]
pH = - (log 2 + log 10-4)
pH = -log2 - log10-4
pH = –log 2 - 4. log 10
pH = –0,3 + 4. (1)
pH = -0,3 + 4
pH = 3,7
2. piemērs: Šķīdumam, ko veido noteikta izšķīdušā viela, hidroksīda jonu koncentrācija ir vienāda ar 10-11 mol / L. Pēc šīs koncentrācijas mēs varam teikt, ka šī šķīduma pH ir vērts?
Lai noteiktu šķīduma pH vērtību pēc hidroksīda koncentrācijas, 10-11 mol / L, mums jādara šādi:
1O Solis: aprēķināt pOH vērtību.
10-OH = [OH-]
10-OH = 10-11
Mums izteiksme jāreizina ar -1, jo pOH vienmēr ir pozitīvs nezināms.
-OH = -11. (- 1)
pOH = 11
2O Solis: aprēķiniet pH vērtību.
pH + pOH = 14
pH + 11 = 14
pH = 14 - 11
pH = 3
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm
