radioaktivitātes likumsjeb radioaktivitātes likumi ir normu vai notikumu kopums, ko atklāj sūdaini un Fajans. Šie divi zinātnieki izstrādāja likumus, kas izskaidro transformācijas, kas notikušas ar nestabilu atoma kodolu pēc izstarošanas alfa starojums vai beta starojums.
Piezīme: A gamma starojums neparādās šo likumu aprakstā, jo tas ir a elektromagnētiskais vilnistāpēc nav iesaistītas kodola daļiņas.
Pēc šo zinātnieku domām, ir divi radioaktivitātes likumi, īpaša alfa starojums un vēl viens beta starojums, kas tiek aplūkoti turpmāk.
Pirmais radioaktivitātes likums
Saskaņā ar Soddy un Fajans teikto, kad radioaktīvā atoma kodols izstaro alfa starojumu, tas vienmēr veido jaunu atomu, kura kodols satur divus protonus un divus neitronus mazāk nekā vecākais atoms.
Šo daļiņu zudums no izcelsmes atoma kodola liek jaunajam kodolam parādīties a atomu skaitlis divas vienības mazākas un masas numurs četras vienības mazāka.
Šo notikumu var attēlot ar šādu vispārējo vienādojumu:

Vienādojums, kas apzīmē pirmo radioaktivitātes likumu
Piemērs: Pieņemsim, ka urāna 238 atoms izstaro alfa starojumu no tā kodola iekšpuses.
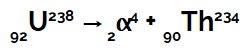
Ķīmiskais vienādojums, kas attēlo urānu izstarojošo alfa starojumu
Mēs varam redzēt, ka tad, kad urāna atoms (masas numurs 238 un atoms 92) izstaro alfa starojumu (masas numurs 4 un atomu numurs 2) veido jaunu torija kodolu, kura masas numurs ir 234 un numurs atomu 90.
Otrais radioaktivitātes likums
Saskaņā ar to radioaktivitātes likums, kad radioaktīvā atoma kodols izstaro beta starojumu, tas vienmēr veido jaunu atomu, kura kodolā ir tāds pats masas skaitlis, bet ar atoma skaitli ir vēl viena vienība vairāk nekā izcelsmi.
Šo notikumu var attēlot ar šādu vispārējo vienādojumu:
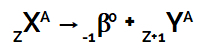
Vienādojums, kas apzīmē otro radioaktivitātes likumu
Piemērs: Kad oglekļa 14 atoms izstaro beta starojumu no tā kodola iekšpuses:
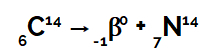
Ķīmiskais vienādojums, kas attēlo oglekli, kas izstaro beta starojumu
Mēs varam redzēt, ka tad, kad oglekļa atoms (masas numurs 14 un atoms 6) izstaro beta starojumu (masas numurs 0 un atomu skaitlis -1) veido jaunu slāpekļa kodolu, kura masas numurs ir 14 un skaitlis atoms 7.
Tas notiek tāpēc, ka, pēc zinātnieka Henriko Fermi domām, kodolā esošais neitrons notiek transmutācijas ceļā, pārveidojot sevi par protonu, neitrīno un elektronu. Elektrons un neitrīno atstāj kodolu, un protons paliek kodolā.
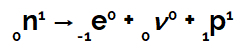
Neitronu transmutācijas vienādojums
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-lei-radioatividade.htm

