Plkst starpmolekulārie spēki ir ķīmijas tēma, kas noteikti var parādīties Valsts vidusskolas eksāmenā (Un nu). Tāpēc šajā rakstā ir vērts apskatīt šī priekšmeta galveno saturu.
Definīcija
starpmolekulārie spēki tie ir dažādas intensitātes (vāja, vidēja vai spēcīga) elektrostatiskās pievilcības spēki vai saites, kas izveidojušās starp vielas molekulām, kas uztur savienojumu starp tām.
Starpmolekulāro spēku veidi
) Inducēts dipols
Un starpmolekulārais spēks kas notiek starp vielas molekulām ar nepolāru raksturlielumu. Tas notiek, piemēram, starp tādu vielu molekulām kā O2, H2, Nē2, CO2, CH4.
Savienība starp šīm molekulām rodas, kad starp tām tiek izveidots dipols. Tas notiek, kad vienas molekulas elektroni izspiež citas elektronus, tādējādi radot negatīvu un pozitīvu polu, kas tiek pārnests no vienas molekulas uz otru.
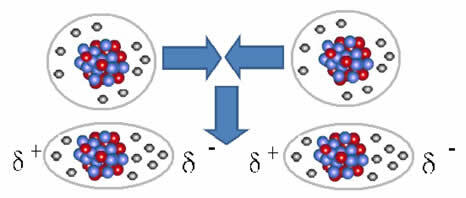
Dipola veidošanās attēlojums nepolārās molekulās
Starp šīm molekulām izveidojās divi stabi, un vienas negatīvais pols mijiedarbojas ar otra pozitīvo polu. Tā kā šie stabi tika izveidoti, tas ir zemas intensitātes starpmolekulārs spēks.
B) pastāvīgs dipols
Un starpmolekulārais spēks kas notiek starp vielas molekulām ar polāru raksturojumu. Piemēri ir tādu vielu molekulas kā HCN, H2O, NH3, CO, CH3Cl.
Savienība starp šīm molekulām notiek, kad vienas negatīvais pols mijiedarbojas ar otras pozitīvo polu.
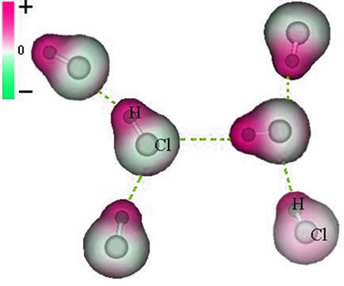
Pastāvīgā dipola spēka attēlojums starp HCl molekulām
Tā kā stabi jau pastāv, pastāvīgajam dipola starpmolekulārajam spēkam ir lielāka intensitāte nekā inducētajam dipolam.
ç) ūdeņraža saites
Tas starpmolekulārais spēks tas notiek starp polārajām molekulām, kurām ūdeņraža atoms ir tieši saistīts ar skābekļa, slāpekļa vai fluora atomu.
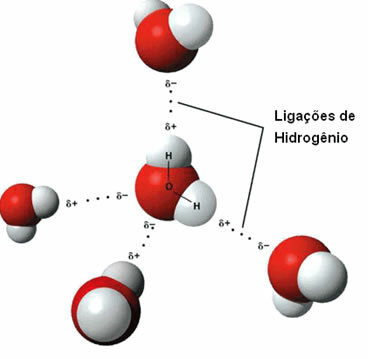
Ūdeņraža saišu attēlojums starp ūdens molekulām
Ūdeņraža saite veidojas, kad ūdeņradis vienā molekulā mijiedarbojas ar otras molekulas skābekli, slāpekli vai fluoru.
d) dipola jons
Šis starpmolekulārais spēks rodas starp polāro molekulu, kurai ir pāris nesaistošu elektronu, un jonu (katjonu vai anjonu) šķīdumā.
Piemēram, ūdens molekulā skābeklī ir divi nesaistošo elektronu pāri. Ja ūdens vidē ir joni, tie tuvojas ūdens molekulai, jo tajā atrodas stabi.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Svarīgums
Cik svarīgi ir zināt starpmolekulārie spēki Enem tā ir izpratne, ko viņi rada attiecībā uz vielu fizikālo stāvokli, kušanas temperatūru, viršanas temperatūru un šķīdību.
) Saistība ar vielas kušanas un viršanas temperatūru
Kušanas temperatūra norāda temperatūru pārejai no cietas uz šķidru stāvokli, un viršanas temperatūra norāda pārejas temperatūru no šķidruma uz gāzveida stāvokli.
Šis fragments ir tieši saistīts ar mijiedarbību starp vielas molekulām, jo tas, kas vienu fizisko stāvokli atšķir no cita, ir tās molekulu agregācijas līmenis.
Tādējādi, jo intensīvāks starpmolekulārais spēks, jo augstāka kušanas un viršanas temperatūra. Jo mazāk intensīvs starpmolekulārais spēks, jo zemākas kušanas un viršanas temperatūras. Tādējādi mēs varam definēt kušanas un viršanas temperatūras dilstošo secību:
Ūdeņraža saite> pastāvīgais dipols> inducētais dipols
B) Saistība ar šķīdību
Kopumā mums jāzina, ka līdzīgais izšķīst līdzīgi, tas ir, polārā viela izšķīdina polāro vielu un nepolārā viela izšķīdina nepolāro vielu.
Tomēr joprojām pastāv mijiedarbības iespēja starp izšķīdušās molekulas un šķīdinātāja molekulām. Tas notiek tikai tad, ja šī jaunā mijiedarbība ir lielāka par to, kas jau pastāv starp pašas vielas molekulām.
Starpmolekulārā spēka pielietošanas piemērs Enem
1. piemērs: (Enem-2011) Cilvēka āda, labi hidratēta, iegūst labu elastību un maigu un gludu izskatu. No otras puses, kad tas ir sauss, tas zaudē elastību un šķiet necaurspīdīgs un raupjš. Lai novērstu ādas sausumu, pēc iespējas ir jāizmanto mitrinoši mitrinošie krēmi, kas parasti izgatavoti no glicerīna un polietilēnglikola:

Ūdens aizture uz ādas virsmas, ko veicina mitrinātāji, ir mitrinošo vielu hidroksilgrupu mijiedarbības ar apkārtējā vidē esošo mitrumu sekas:
a) jonu saites
b) Londonas spēki
c) kovalentās saites
d) dipola-dipola spēki
e) ūdeņraža saites
Atbilde uz šo jautājumu ir ūdeņraža savienojums, jo ūdens molekula ir savienota ar ūdeņradi ar skābekļa atomu. Tas pats notiek ar propilēnglikola un polietilēnglikola molekulām, kas ir labvēlīgs nosacījums šāda veida starpmolekulārā spēka rašanās gadījumam.
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Starpmolekulārie spēki inem"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Piekļuve 2021. gada 27. jūnijam.