Reakcijas ātruma likums attiecas uz ķīmiskās pārveidošanās ātrumu ar reaģentu koncentrācijām vielas daudzumā (mol / L), ko var norādīt šādi:

Piemēram, apsveriet šādu vispārīgu reakciju:
aA + bB → cC + dD
Pieņemsim, ka mēs palielinām reaģentu A un B koncentrāciju, kas notiks ar reakcijas ātrumu? Nu, tā kā reaģenta daļiņu daudzums palielināsies tajā pašā telpā, starp tām būs efektīvākas sadursmes, kā rezultātā palielināsies reakcijas attīstības ātrums. Tas nozīmē, ka tas palielinās jūsu ātrumu.
Tāpēc reakcijas ātrums ir tieši proporcionāls reaģentu koncentrācijai. Tomēr tas ir atkarīgs arī no temperatūras. Tāpēc mums ir šāds matemātiskais vienādojums, kas attēlo reakcijas ātruma likumu:

Uz ko:
v = reakcijas ātrums;
k = konstante, kas atkarīga tikai no temperatūras vērtības;
α un β = eksperimentāli noteiktie eksponenti.
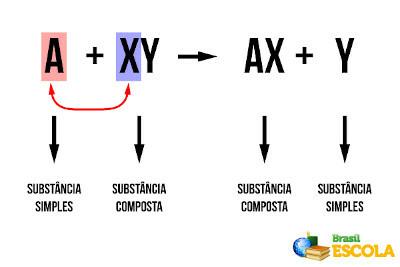
Tikai tad, ja reakcija ir elementāra, tas ir, tā notiek vienā posmā, eksponenti ir tieši vienādi ar līdzsvarotā ķīmiskā vienādojuma koeficientiem: v = k. [THE]The. [B]B. Tomēr citos gadījumos eksperimentāli jānosaka piemērotā iedarbība, līdz kurai jāpalielina katra reaģenta koncentrācija.
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Reakcijas ātruma likums iet daudzos vārdos, šeit ir daži: Masu darbības likums, ātruma vienādojums, reakcijas kinētiskais likums un Guldberga-Veidža likums.
Apsveriet piemēru, kā piemērot šo likumu:
Apsveriet šādu elementāru reakciju:
2 HCl g) → H2. punkta g) apakšpunkts + Cl2. punkta g) apakšpunkts
a) Uzrakstiet šīs reakcijas ātruma vienādojumu;
b) Veicot eksperimentus, zemāk esošajā tabulā tika atzīmēts šīs sērūdeņraža hlorūdeņraža sadalīšanās ātrums un šī reaģenta koncentrācija nemainīgā 25 ° C temperatūrā:
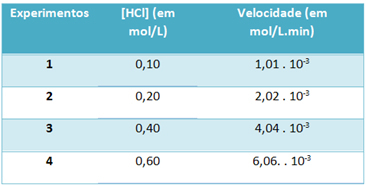
Pamatojoties uz to, nosakiet šīs reakcijas raksturīgo ātruma konstanti minētajā temperatūrā.
Izšķirtspēja:
) v = k. [HCl]2
b) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol. L-1. min-1
0,01 mol. L-1
k = 1,01. 10-1 min-1
Lai atrisinātu burtu “b”, varat izmantot jebkura eksperimenta datus, ka iegūtā vērtība būs vienāda.
Bet ja reakcija nav elementāra? Kā šādus jautājumus būs iespējams atrisināt neelementārās reakcijās? Lai uzzinātu, kā to izdarīt, izlasiet ātruma likumu par elementārām reakcijām.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Ķīmisko reakciju ātruma likums"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm. Piekļuve 2021. gada 27. jūnijam.